Questões Militares
Comentadas sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 51 questões
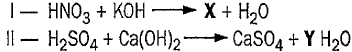
Considere as seguintes equações de neutralização total representadas abaixo.
A maior parte da produção de amônia, nos dias atuais, é utilizada para a produção de fertilizantes. Esse processo é conhecido como Haber-Bosch. Parte de nitrogênio (N2) e Hidrogênio (H2) formando a amônia (NH3). A reação é executada entre 400 e 450° C e 600 atm (atmosferas) e pode ser representada pela equação abaixo.
______ N2(g) + ______ H2(g) ⇔ ______ NH3(g)
Assinale a alternativa que completa correta e respectivamente as lacunas nos balanceamentos da reação acima.
Em condições ideais, pequenas quantidades de gás cloro podem ser geradas em laboratório pela reação do óxido de manganês (MnO2 ) com ácido clorídrico (HCl), conforme a equação química a seguir não balanceada.
HCl(aq) + MnO2 (s) → H2O(L) + MnCl2(s) + Cl2(g)
A partir dessas informações, quantas moléculas de gás cloro, aproximadamente, podem ser produzidas quando 10 g de óxido de manganês com grau de pureza de 87% são colocados para reagir completamente com excesso de ácido clorídrico?
Dado: Número de Avogadro (N) = 6 x 1023
A pólvora é material empregado como propulsor em armas de fogo. Basicamente, a ideia é provocar uma reação que gere uma quantidade grande de gases sob pressão e temperatura elevadas. Ao se expandirem, esses gases impulsionam um projétil. A pólvora negra, empregada em armas mais antigas, é constituída por uma mistura de salitre (KNO3), enxofre (S) e material de carbono (C). A equação não balanceada de uma das reações químicas que ocorrem durante a queima da pólvora é apresentada a seguir.
KNO3 (s) + S (s) + C (s) → K2S (s) + N2 (g) + CO2 (g)
Considerando essas informações e sabendo que o número atômico do carbono é igual a 6, julgue o item que se segue.
A menor soma de coeficientes estequiométricos inteiros que
permitem balancear a equação química apresentada é igual a 8.
A pólvora é material empregado como propulsor em armas de fogo. Basicamente, a ideia é provocar uma reação que gere uma quantidade grande de gases sob pressão e temperatura elevadas. Ao se expandirem, esses gases impulsionam um projétil. A pólvora negra, empregada em armas mais antigas, é constituída por uma mistura de salitre (KNO3), enxofre (S) e material de carbono (C). A equação não balanceada de uma das reações químicas que ocorrem durante a queima da pólvora é apresentada a seguir.
KNO3 (s) + S (s) + C (s) → K2S (s) + N2 (g) + CO2 (g)
Considerando essas informações e sabendo que o número atômico do carbono é igual a 6, julgue o item que se segue.
Entre os produtos da reação química apresentada, podem ser
identificadas uma substância iônica e duas substâncias
moleculares; entre as substâncias moleculares, uma é polar e,
a outra, apolar.
Com relação a reações químicas e a substâncias, julgue o item subsequente.
No balanceamento de uma equação química, o número
de substâncias no reagente tem que ser igual ao número
de substâncias no produto.
Acerca dos diferentes tipos de ligações químicas e das substâncias formadas em reações químicas, julgue o próximo item.
Nas moléculas, os átomos das substâncias são organizados
linearmente de acordo com sua fórmula molecular.
Na ânsia pelo "elixir da longa vida", por volta do século I, alquimistas descobriram acidentalmente a Pólvora, referenciada em textos de Alquimia pelos avisos quanto aos cuidados para não se misturarem certos materiais uns com os outros. A pólvora, mais conhecida desde o final do século XIX como pólvora negra, é uma mistura química que queima com rapidez. Foi extensamente utilizada como propelente em canhões e armas de fogo e atualmente ainda é empregada em artefatos pirotécnicos. Nitrato de potássio, enxofre e carvão (carbono) são os constituintes da pólvora negra. Sobre as espécies constituintes da pólvora negra afirma-se que
Dados:
Número Atômico: K = 19; N = 7; O = 8; S = 16; C = 6
I - o nitrato de potássio é classificado como uma base segundo a teoria de Arrhenius;
II - a 25 °C e 1 atm a variedade alotrópica mais estável do carbono é a grafite e a do enxofre é a rômbica;
III - a fórmula do nitrato de potássio é KNO2 ;
IV - o enxofre é um metal radioativo que pertence à família 6A (16) da tabela periódica;
V - o átomo de carbono (6C) estabelece 4 ligações químicas e possui a variedade alotrópica diamante, substância natural de alta dureza;
Estão corretas apenas as afirmativas
A emissão de gases derivados do enxofre, como o dióxido de enxofre (SO2), pode ocasionar uma série de problemas ambientais e a destruição de materiais como rochas e monumentos à base de calcita (carbonato de cálcio). Essa destruição ocasiona reações com a emissão de outros gases, como o gás carbônico (CO2), potencializando o efeito poluente. Considerando as equações das reações sucessivas a 27 °C e 1 atm, admitindo-se os gases como ideais e as reações completas, o volume de CO2 produzido a partir da utilização de 2 toneladas de SO2 como reagente é, aproximadamente,
Dados
Massas Atômicas: S = 32 u ; O = 16 u ; H = 1 u ; C = 12 u ; Ca = 40 u
Constante dos gases ideais: R = 0,082 atm L
L mol-1
mol-1 K-1
K-1
Volume molar nas condições em que ocorreu a reação (27° e 1 atm) = 24,6 L/mol
SO2 (g) + 1/2 O2 (g) → SO3 (g) (equação I)
SO3 (g) + H2O (ℓ) → H2SO4 (ℓ) (equação II)
H2SO4 (ℓ) + CaCO3 (s) → CaSO4 (s) + H2O (ℓ) + CO2 (g) (equação III)
Leia as informações da tabela a seguir que representa alguns ácidos e suas aplicações.
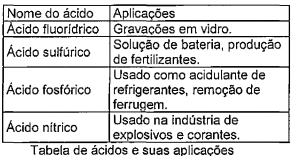
As fórmulas dos ácidos citados na tabela acima são,
respectivamente:
CrCl3 + NaOH + H2O2 → Na2CrO4 + NaCl + H2O
Butano é o gás armazenado em botijões ou encanamentos, usado no cozimento dos alimentos.
O gás butano, derivado do petróleo, é uma substância inodora e incolor. Devido a essas características outros elementos costumam ser acrescentados ao butano, para que, em caso de vazamento, possa se sentir o cheiro e evitar possíveis acidentes.

A combustão completa desse gás produz gás carbônico e água segundo a equação não balanceada a seguir
C4H10(g) + O2(g) → CO2(g) + H2O(l)
O balanceamento correto dessa equação permite concluir que,
para cada molécula de butano queimada, há produção de
O cobre metálico pode ser oxidado por ácido nítrico diluído, produzindo água, monóxido de nitrogênio e um sal (composto iônico). A reação pode ser representada pela seguinte equação química (não balanceada):
Cu (s) + HNO3 (aq) → H2O (l) + NO (g) + Cu(NO3)2 (aq)
A soma dos coeficientes estequiométricos (menores números inteiros) da equação balanceada,
o agente redutor da reação e o nome do composto iônico formado são, respectivamente,