Questões Militares
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 97 questões
O gráfico a seguir apresenta os resultados obtidos para a relação entre massa e volume de cada uma dessas amostras, medidos a 25ºC.
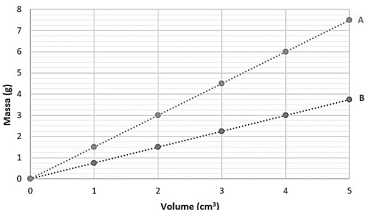
A partir dos dados apresentados é possível afirmar que, nessa temperatura, a razão entre as densidades das amostras A e B é igual a
Pb(NO3)2 + 2KI → PbI2 + 2KNO3 CH3NH2 + HI → CH3NH3I PbI2 + CH3NH3I → CH3NH3PbI3
Os seguintes reagentes foram empregados na síntese: 0,6 mol de Pb(NO3)2; 0,8 mol de KI; 0,7 mol de CH3NH2; e 0,8 mol de HI. Nessas condições, qual será a quantidade máxima da perovskita CH3NH3PbI3 produzida?
Considerando o nível de glicose citado de 50mg/dL (considere 1dL = 0,1L), é CORRETO afirmar que a conversão desta unidade de concentração em mmol/L de glicose chegará ao valor aproximado de:
H2(g) + O2(g) → H2O(l)
É CORRETO afirmar que, para 342g de gás oxigênio, a massa de gás hidrogênio necessária para a reação completa será aproximadamente de:
2. HCOONa + H2SO4 → 2HCOOH + Na2SO4
Uma solução aquosa foi preparada a partir da dissolução de 6,8 g de metanoato de sódio em 100 ml de água. Essa solução preparada reagiu com uma solução de ácido sulfúrico com centração de 0,2 mol/L para formação do ácido fórmico. Sabendo que a quantidade de solução de ácido sulfúrico foi a quantidade estequiométrica para completar a reação de síntese, a concentração da solução de metanoato de sódio preparada e a quantidade de solução de ácido sulfúrico adicionada, respectivamente, foram:
Massa molar: Na=23 g/mol; C=12 g/mol; O=12 g/mol; O=16 g/mol; H=1 g/mol
Sobre esse assunto, é correto afirmar que:
Dados – M (g mol-1 ): H = 1; C = 12; N = 14; O = 16.
Qual é o valor da massa molar (em g mol-1 ) desse composto?
O sulfeto de alumínio é um sólido que pode ser obtido, em condições adequadas, entre a reação do alumínio e do gás sulfeto de hidrogênio de alta pureza. Nessa reação, forma-se gás hidrogênio como subproduto.
Ao serem misturados 3,0 mol de alumínio e 6,0 mol de sulfeto de hidrogênio nas condições adequadas para reação, a quantidade máxima, em mol, de sulfeto de alumínio que poderá ser formada e a massa do reagente em excesso são:
A fosfina, PH3 , é uma substância gasosa em temperatura ambiente que pode ser obtida a partir da reação do fosfeto de cálcio sólido com água. Nessa reação, forma-se também o hidróxido de cálcio.
Uma certa massa de fosfeto de cálcio foi adicionada em água em um béquer aberto totalizando uma mistura reacional com massa igual a 1.000 g. Ao término da reação com consumo total do fosfeto de cálcio, a massa da mistura no interior do béquer era igual a 796 g.
A massa de água da mistura reacional no béquer era igual a
2 H2(g) + O2(g) → 2 H2O(g)
Nessa reação, o hidrogênio reage com o oxigênio em proporção 1:8 (em massa).
A esse respeito, analise as afirmativas a seguir.
I. A combustão completa de 5g de hidrogênio requer 40g de oxigênio.
II. A mistura de 4g de hidrogênio com 16g de oxigênio deverá gerar 20g de água.
III. A combustão de 2g de hidrogênio gera 2g de água.
Está correto o que se afirma em