Questões Militares
Comentadas sobre interações atômicas: geometria molecular, polaridade da ligação e da molécula, forças intermoleculares e número de oxidação. em química
Foram encontradas 85 questões
I. ClO–3 e NO–3 possuem geometria piramidal e trigonal respectivamente.
II. A geometria molecular do PCl5 é uma bipirâmide de base triangular.
III.H2S possui geometria linear.
Está(ão) correta(s) a(s) afirmativa(s)
I. H3C – CH2 – CH2 – OH com H3C – CH2 – CH2 – OH.
II. HBr com HBr.
III. CH3NH2 com CH3NH2.
IV.C5H12 com C5H12.
Sobre o tipo de forças intermoleculares que existem em cada uma das substâncias anteriores, assinale a alternativa correta.
Das afirmativas apresentadas está(ão) correta(as)
Ponto de ebulição dos hidretos do grupo 4A e 6A em função da massa molecular.
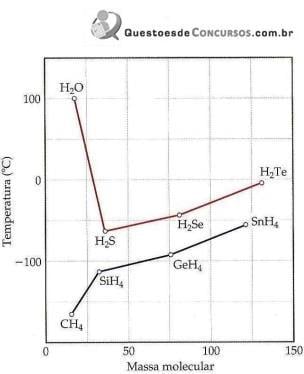
(Química Ciência Central.)
Sobre a imagem e intensidade das forças intermoleculares, analise.
I. No geral, o ponto de ebulição de compostos de hidrogênio torna-se maior com o aumento da massa molecular, devido ao acréscimo das forças de dispersão.
II. Os compostos NH3 e HF também têm pontos de ebulição altos.
III. A ligação de hidrogênio é um tipo de atração intermolecular entre o átomo de hidrogênio em uma ligação apolar (particularmente uma ligação com F, O ou N) e um par de elétrons não compartilhado em um íon ou átomo pequeno e eletronegativo que esteja próximo (geralmente um átomo de F, O ou N em outra molécula).
Está(ão) correta(s) apenas a(s) afirmativa(s)
Analise as afirmativas abaixo, relacionadas aos compostos iônicos .
I - Apresentam elevados pontos de fusão e de ebulição.
II - São sólidos nas condições ambientes de temperatura e pressão.
III- Conduzem corrente elétrica quando dissolvidos em água.
IV - São exemplos de compostos iônicos: Cloreto de Sódio e Diamante.
Assinale a opção correta.
I. Em uma solução de NaCℓ em água há interações íon-dipolo. II. Em uma solução de oxigênio (O2) em água há interações dipolo - dipolo induzido. III. Em uma solução de iodo (I2) em tetracloreto de carbono (CCℓ4) há interações dipolo instantâneo-dipolo induzido.
Pb(s) + PbO2(s) + 2H2SO4(aq) → 2Pb2+ SO4 2- (aq) + 2H2O(ℓ)
Para uma molécula diatômica, a energia potencial em função da distância internuclear é representada pela figura ao lado. As linhas horizontais representam os níveis de energia vibracional quanticamente permitidos para uma molécula diatômica. Uma amostra contendo um mol de moléculas diatômicas idênticas, na forma de um sólido cristalino, pode ser modelada como um conjunto de osciladores para os quais a energia potencial também pode ser representada qualitativamente pela figura. Em relação a este sólido cristalino, são feitas as seguintes proposições:
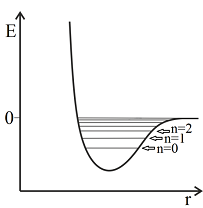
I. À temperatura de 0 K, a maioria dos osciladores estará estado vibracional fundamental, cujo número quântico vibracional, n, é igual a zero.
II. À temperatura de 0 K, todos os osciladores estarão no estado vibracional fundamental, cujo número quântico vibracional, n, é igual a zero.
III. O movimento vibracional cessa a 0 K.
IV. O movimento vibracional não cessa a 0 K.
V. O princípio de incerteza de Heisenberg será violado se o movimento vibracional cessar.
Das proposições acima estão CORRETAS
Dados: 1H1; 6C12; 8O16; 16S32; 7N14
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
O estado de oxidação do bário é mais reduzido na forma metálica desse elemento que na estrutura da substância que resulta como produto de sua queima.
No livro de Robson Fernandes de Farias,
Introdução à química forense, publicado pela editora
Átomo, de Campinas, na 2ª edição, datada de 2008,
na página 71, é dito que:
“A técnica mais utilizada [para a identificação de digitais] consiste na aplicação de uma fina camada de pó sobre o local onde, acredita-se, possa haver impressões digitais. Uma vez que impressões tenham sido assim reveladas, segue-se a etapa do decalque. Tal técnica baseia-se na aderência de um determinado pó sobre os diversos compostos químicos que compõem a impressão. Ligações de hidrogênio e forças de Van der Walls, são, essencialmente, as responsáveis por esta interação”.
Considere as assertivas a seguir:
I – A agregação da fina camada de pó sobre a impressão digital é devida às interações de dipolo elétrico entre as moléculas de água e as partículas do pó.
II – A agregação da fina camada de pó sobre a impressão digital é devida à formação da ligação iônica entre o pó e a água contida na impressão digital.
III – A técnica de análise da impressão digital (papiloscopia), assim como o teste de DNA, diferencia até gêmeos idênticos (univitelinos).
Assinale a alternativa correta:
Dado: Carga formal = V - (L - 0,5.B)
V - n° de elétrons de valência
L - n° de elétrons presentes em pares isolados
B - n° de elétrons compartilhados
A ordem crescente de ponto de ebulição para essas substâncias é