Questões Militares Comentadas sobre química
Foram encontradas 976 questões
A tabela abaixo apresenta as temperaturas de fusão e ebulição das substâncias Mercúrio, Fenol, Cobalto, Alumínio e Ácido Acético.

Em relação aos estados físicos das substâncias, marque a
opção correta.
A partir do dia 24 de março de 2021, o Primeiro Batalhão de Bombeiros Militar, em parceria com a Prefeitura de Belo Horizonte, passou a funcionar como um posto fixo para campanha de vacinação contra a Covid-19. As vacinas contra a Covid-19 foram desenvolvidas muito rapidamente e sua constituição química pode variar dependendo da vacina e do fabricante. A vacina da Pfizer, por exemplo, possui em sua constituição, dentre várias substâncias, cloreto de sódio (NaCl), dihidrogenofosfato de potássio (KH2 PO4 ), sacarose (C12H22O11) e fosfato de sódio (Na3 PO4 ).
A respeito das propriedades físico-químicas das substâncias presentes na vacina da fabricante Pfizer, assinale a alternativa correta.
Conforme descrito pelo Corpo de Bombeiros Militar de Minas Gerais, um incêndio destruiu parte de uma casa no norte do estado de Minas Gerais. O acidente ocorreu quando uma criança de 4 anos brincava com uma caixinha de fósforos.
Disponível em: https://www.otempo.com.br/cidades/paisdeixam-crianca-de-4-anos-brincar-com-fosforo-e-casa-eincendiada-em-mg-1.2430627. Acesso em: 3 ago. 2021
(adaptado).
Na ponta do palito de fósforos existem várias substâncias, entre elas o trissulfeto de tetrafósforo (P4 S3 ). Essa substância inflama-se na presença de oxigênio, conforme descrito na equação química não balanceada a seguir:
P4 S3(s) + O2(g) → P4O10(s) + SO2(g)
Considerando que um palito de fósforo é constituído por 1.000 mg dessa substância, que por sua vez possui 40% em massa de trissulfeto de tetrafósforo, qual é a massa mais próxima do gás dióxido de enxofre (SO2 ), produzida quando um palito de fósforo se queima completamente?
Um dos equipamentos essenciais utilizados pelo militar do Corpo de Bombeiros é o capacete de segurança. O capacete é feito para proteção integral do crânio e da face contra os choques mecânicos, as chamas e o calor. Sua estrutura externa é moldada em poliamida, um polímero de cadeia longa que contém o grupo amida.
O grupo funcional que faz parte da constituição química da poliamida é o:
Acidentes com gases tóxicos se tornam cada vez mais frequentes no Brasil. Segundo especialistas militares do Corpo de Bombeiros, o gás tóxico presente em unidades frigoríficas, indústrias de pescados e laticínios e em unidades de refrigeração industrial é o responsável por grande parte dos acidentes.
Esse gás apresenta um odor característico forte, quimicamente sua molécula é polar, e a sua estrutura contém quatro nuvens eletrônicas ao redor do átomo central, por meio da qual esse átomo apresenta um par de elétrons não ligante.
De acordo com as características da estrutura química desse composto gasoso, qual é a sua fórmula molecular?
Uma das ações do Corpo de Bombeiros Militar é orientar os banhistas de rios e lagoas quanto aos riscos de nadarem alcoolizados. Esses banhistas estão sujeitos ao afogamento, pois, ao consumirem álcool, ficam com a coordenação motora comprometida e perdem a percepção do perigo. Para ficar embriagada, uma pessoa que pesa 70 kg precisa ingerir 15 mL de etanol puro, que se acumula na corrente sanguínea, deixando-a sujeita ao afogamento.
Com base nas condições descritas e considerando que o teor alcoólico de uma cerveja seja de 5% V/V, qual quantidade mínima dessa bebida, em mililitros, ingerida por um indivíduo, poderia caracterizar sua embriaguez?
Em um experimento laboratorial, misturou-se 25 mL de uma solução aquosa de ácido clorídrico com concentração 0,8 mol L-1 com 25 mL de uma solução aquosa de hidróxido de sódio com concentração 0,6 mol L-1 .
Acerca do experimento, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de neutralização.
II – A substância de caráter alcalino (básico) está em excesso estequiométrico.
III – A solução resultante após a reação possui caráter ácido.
IV – Após a reação, o pH da solução resultante possui valor igual a 2.
Das afirmativas feitas, estão corretas apenas
Leia o texto a seguir e resolva a questão:
“A ozonólise utiliza ozônio (O3) na presença de água (H2O) e zinco (Zn). O ozônio adiciona-se à dupla ligação do alqueno, originando um composto intermediário instável, denominado ozoneto ou ozonida. O ozoneto, por sua vez, se hidrolisa, originando aldeídos e/ou cetonas. A finalidade da utilização do zinco é evitar que o oxigênio, que pode ser produzido pela decomposição da água oxigenada, oxide o aldeído, transformando-o em ácido carboxílico.”
Fonte: modificado de USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 3: Química Orgânica. p. 348.
Sabe-se que a ozonólise de um alqueno genérico denominado A, produziu os compostos propanona e propanal como produtos, além da substância H2O2.
A + O3 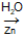 propanona + propanal + H2O2
propanona + propanal + H2O2
Acerca desta reação e de seus reagentes e produtos, são feitas as seguintes afirmativas:
I – De acordo com a IUPAC, o nome oficial da substância A é 2-metilpent-2-eno.
II – O nome da substância H2O2 é superóxido de hidrogênio.
III – O grupo orgânico carbonila está presente nas três substâncias orgânicas (substância A, propanona e propanal).
IV – Os compostos A, propanona e propanal têm em sua estrutura ao menos um carbono com hibridização sp2 .
V – A cadeia carbônica da substância A é ramificada.
Das afirmativas feitas, estão corretas apenas
Leia o texto a seguir e resolva a questão:
“Quando se efetuam duas substituições em um anel aromático, verifica-se experimentalmente que a posição da segunda substituição no anel depende da estrutura do primeiro grupo substituinte, ou seja, o primeiro ligante do anel determinará a posição preferencial para a outra substituição. Esse fenômeno recebe o nome de dirigência e existem somente dois tipos de dirigentes: ortoparadirigentes e metadirigentes.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 3: Química Orgânica. p. 318.
Considere a mononitração de um composto hipotético de fórmula C6H5X, em presença de ácido sulfúrico como catalisador. Esta mononitração pode gerar como produtos os compostos A, B e C, cuja reação é representada abaixo:
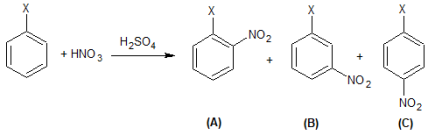
Acerca dessa reação e de seus compostos, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de condensação.
II – Caso X seja um haleto, os compostos A e C serão os produtos preferencialmente formados na reação.
III – Caso X seja o grupo metila (–CH3), o composto B será o produto preferencialmente formado na reação.
IV – Caso X seja o grupo nitro (–NO2), o composto B será o produto preferencialmente formado na reação.
V – Os compostos A, B e C são isômeros de função.
Das afirmativas feitas, estão corretas apenas
Considere a equação da reação hipotética: X + Y + Z → W + T + Q
São conhecidos os seguintes resultados do estudo cinético desta reação, obtidos nas mesmas condições experimentais:
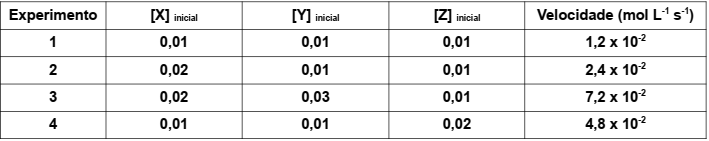
Considere [ ] = concentração mol L-1
.
A partir das observações experimentais, conclui-se que a equação da velocidade para a reação é
“Em 1836, o químico inglês John Frederic Daniell construiu uma pilha usando metais e soluções aquosas de sais. A pilha funcionava a partir de dois eletrodos interligados. O eletrodo é, geralmente, um sistema constituído por um metal imerso em uma solução aquosa de um sal formado pelos cátions desse metal.”
Adaptado de: FONSECA, Martha Reis Marques. Química. São Paulo: Editora FTD, 2007. v. 2: Físico-Química. p. 276.
Considere a representação da notação química da pilha de Daniell (usando eletrodos de cobre e zinco), de acordo com a União Internacional de Química Pura e Aplicada (IUPAC):
Zn (s) | Zn2+ (aq) (1 mol L-1) || Cu2+ (aq) (1 mol L-1) | Cu (s).
Dados os potenciais padrão de redução E0 Zn = - 0,76 V e E0 Cu = + 0,34 V, e considerando o funcionamento da referida pilha em condições padrão, afirma-se que
I – no eletrodo de cobre dessa pilha ocorre a corrosão da placa metálica de cobre.
II – a diferença de potencial (d.d.p.) teórica dessa pilha é de + 1,10 V.
III – nessa pilha os elétrons fluem no circuito externo, do eletrodo de zinco para o eletrodo de cobre.
IV – o símbolo de duas barras paralelas ( || ) representa a ponte salina (ou uma membrana porosa), cuja finalidade é manter as duas semicelas eletricamente neutras, por meio da migração de íons (corrente iônica).
V – a equação da reação global dessa pilha é Zn2+ (aq) + Cu (s) → Zn (s) + Cu2+ (aq).
Das afirmativas feitas, estão corretas apenas
Leia os textos a seguir e resolva a questão:
“Nas equações químicas, tanto as substâncias transformadas (reagentes) como as produzidas são representadas por fórmulas. As fórmulas das substâncias indicam elementos que as constituem e, também, a quantidade de átomos de cada elemento. O número que indica essa quantidade de átomos é chamado índice, que é anotado à direita do símbolo de cada elemento. (...)
A quantidade de cada substância que participa da reação é indicada por números escritos antes de suas fórmulas, denominados coeficientes estequiométricos, que devem ser os menores números inteiros possíveis.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 1: Química Geral. p. 385.
“Em uma reação de oxidorredução, o mais comum é que uma espécie se oxide e outra se reduza. Porém, podem ocorrer casos com duas ou mais oxidações e apenas uma redução ou viceversa. De qualquer maneira, para o balanceamento desse tipo de reação, o princípio é sempre o mesmo: n° de elétrons perdidos = n° de elétrons recebidos.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 2: Físico-Química. p. 250.
Considere a seguinte equação de reação química de oxidorredução não balanceada:
As2S3 + NH4OH + H2O2 → (NH4)3AsO4 + (NH4)2SO4 + H2O
Acerca desta reação química de oxidorredução e de suas espécies, são feitas as seguintes afirmativas:
I – O peróxido de hidrogênio é o agente redutor.
II – Após o devido balanceamento, o coeficiente estequiométrico da água é 20.
III – O arsênio da substância As2S3 é reduzido, enquanto o enxofre é oxidado.
IV – O (NH4)2SO4 é um sal cujo nome é sulfito de amônio.
V – Após o devido balanceamento, a soma de todos os coeficientes estequiométricos da equação é igual a 52.
Das afirmativas feitas, estão corretas apenas
No estado sólido, o dióxido de carbono é conhecido como gelo seco. Em condições ambientes (25 ºC e 1 atm), ele passa do estado sólido para o estado de vapor. Acerca do dióxido de carbono, são feitas as seguintes afirmativas:
I – O dióxido de carbono é classificado como uma substância simples.
II – O dióxido de carbono é uma substância que sublima em condições ambientes.
III – A molécula do dióxido de carbono apresenta geometria angular.
IV – O dióxido de carbono é um óxido ácido que, em condições adequadas, pode reagir com água e produzir o ácido carbônico.
V – Quando se borbulha dióxido de carbono em uma solução aquosa de hidróxido de cálcio, sob condições adequadas, produz-se carbonato de cálcio e água.
VI – A hibridização do átomo de carbono na molécula do dióxido de carbono é sp2 .
Das afirmativas feitas, estão corretas apenas
Leia o texto a seguir e resolva a questão:
“ Batalhão realiza marcha a pé de 8 k m, como atividade
do Programa de Instrução de 2021
Aquidauana (MS) – No dia 11 de março, o 9º Batalhão de Engenharia de Combate (9º BE Cmb), Batalhão Carlos Camisão, seguindo o cronograma de Instrução de 2021, realizou a marcha a pé de 8 km. A atividade teve por finalidade desenvolver a rigidez, disciplina no deslocamento a pé, capacitação profissional e manutenção da operacionalidade da tropa.”
Fonte: https://www.eb.mil.br/web/noticias/noticiario-do-exercito. Acessado em 16 MAR 21.
Atividades físicas intensas promovem a perda de água e de eletrólitos. Para repor essas perdas, soldados podem consumir um repositor hidroeletrolítico durante a atividade de campanha. Esses repositores são constituídos de uma solução aquosa contendo várias substâncias químicas, principalmente sais.
Considere um repositor que possua as seguintes especificações: cada porção de 200 mL contém 90 mg de íons sódio, 24 mg de íons potássio e 84 mg de íons cloreto.
Baseado nestas informações, são feitas as seguintes afirmativas:
I) A concentração de íons sódio na solução é de 0,45 g L-1 .
II) Cada litro do repositor possui aproximadamente 3,1 x 10-3 mol de íons potássio.
III) A temperatura de congelamento de uma porção de repositor é maior do que a temperatura de congelamento da água pura nas mesmas condições.
IV) Para se obter 0,2 mol de íons cloreto, seriam necessários aproximadamente 100 litros de repositor.
Das afirmativas feitas, estão corretas apenas
Leia o texto a seguir e resolva a questão:
“Soldados recebem palestra sobre ansiedade e depressão
Cascavel (PR) – O 15º Batalhão Logístico promoveu, no dia 11 de março, uma palestra com o tema “Ansiedade e Depressão na Juventude”. A atividade foi voltada para os jovens soldados recém-incorporados às fileiras do Exército. Colaborou com a atividade o Dr. Marco Antônio da Silva Cristovam, professor e médico pediatra com área de atuação em Medicina do Adolescente. A atividade faz parte do Programa de Valorização da Vida.”
Fonte: https://www.eb.mil.br/web/noticias/noticiario-do-exercito. Acessado em 16 MAR 21.
Atualmente, medicamentos à base de sais de lítio (Li) vêm sendo empregados para o tratamento de casos de depressão em pacientes maníaco-depressivos. A respeito do elemento químico lítio e de suas espécies químicas, avalie as seguintes afirmativas:
I) Um átomo neutro de lítio com número de massa 7 possui 3 prótons, 3 elétrons e 4 nêutrons.
II) O íon Li1+ possui distribuição eletrônica semelhante à de um átomo neutro de berílio.
III) O átomo de lítio é o que possui o menor raio atômico dentre os metais alcalinos.
IV) O estabelecimento da ligação química entre um átomo de lítio e um átomo de cloro, no sal cloreto de lítio, dá-se por meio de uma ligação iônica.
V) O elemento químico lítio está localizado no grupo 2 e no período 1 da Tabela Periódica.
Das afirmativas feitas, estão corretas apenas
Considere a tabela de temperaturas de fusão (TF) e temperaturas de ebulição (TE) de algumas substâncias hipotéticas, todas sujeitas às mesmas condições de pressão.
Material TF (ºC) TE (ºC)
Alpha - 101 - 34
Bravo - 116 35
Charlie 41 182
Delta 3550 4827
Echo - 95 110
Acerca desta tabela e de seus dados, são feitas as seguintes afirmativas:
I – À temperatura de 25 ºC, o material Alpha está no estado sólido.
II – À temperatura de 50 ºC, os materiais Bravo e Delta estão no estado líquido.
III – À temperatura de 30 ºC, os materiais Charlie e Echo estão no estado gasoso.
IV – À temperatura de 145 ºC, os materiais Alpha, Bravo e Echo estão no estado gasoso.
V – À temperatura de 1450 ºC, o material Delta está no estado sólido.
Das afirmativas feitas, estão corretas apenas
Segundo as leis da radioatividade, um átomo de um elemento químico radioativo pode emitir várias partículas, como a alfa (α) e a beta (β), além de radiações de ondas eletromagnéticas, como a gama (ɣ). Considere as seguintes afirmativas acerca dessas emissões radioativas e de suas implicações:
I – A perda de uma partícula beta (β) por um átomo de um elemento radioativo ocasiona a formação de um átomo de número atômico maior.
II – A emissão de radiação gama (ɣ), a partir do núcleo de um átomo radioativo, não altera o número atômico e o número de massa deste átomo.
III – A emissão consecutiva de três partículas alfa (α) e duas beta (β), na desintegração do
isótopo radioativo 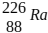 , gera o átomo do elemento químico
, gera o átomo do elemento químico 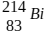 .
.
IV – O decaimento radioativo do átomo do elemento Roentgênio-272 (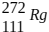 ), representado
pelo esquem
), representado
pelo esquem 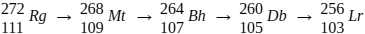 , denota a emissão exclusiva de
radiação gama (ɣ).
, denota a emissão exclusiva de
radiação gama (ɣ).
Das afirmativas feitas, estão corretas apenas
TRATAMENTOS (1) Pintura (2) Plastificação (3) Anodização (4) Galvanoplastia (5) Proteção catódica
DEFINIÇÕES ( ) Técnica que consiste em cobrir uma peça de metal com outro metal diferente por meio do processo da eletrólise. ( ) Coloca-se um metal em contato com aquele que se deseja proteger. ( ) Forma-se um óxido (composto por átomos do próprio metal) que recobre o metal, protegendo-o. ( ) Utiliza-se um revestimento de polímero orgânico para recobrir uma peça metálica. ( ) Cobre-se a superfície metálica com uma camada de tinta para evitar o contato do ar e da umidade com o metal.
A sequência correta dessa associação é
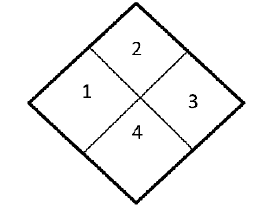
De acordo com o diagrama, a relação entre a cor e o que ela representa na classificação de riscos de produtos químicos está corretamente indicada em
Sobre os tipos de classes, é correto afirmar que