Questões Militares Comentadas sobre química
Foram encontradas 976 questões
Sobre as ligações iônicas, assinale a alternativa que completa correta e respectivamente as lacunas do texto.
Os compostos iônicos são resultados da reação entre um metal e um ametal. Os elétrons são transferidos do ______________ para o _______________ formando os ______________ e os ________________ respectivamente. Um exemplo de reação desse tipo ocorre quando colocamos gás cloro em contato com sódio metálico, formando assim o cloreto de sódio.
A maior parte da produção de amônia, nos dias atuais, é utilizada para a produção de fertilizantes. Esse processo é conhecido como Haber-Bosch. Parte de nitrogênio (N2) e Hidrogênio (H2) formando a amônia (NH3). A reação é executada entre 400 e 450° C e 600 atm (atmosferas) e pode ser representada pela equação abaixo.
______ N2(g) + ______ H2(g) ⇔ ______ NH3(g)
Assinale a alternativa que completa correta e respectivamente as lacunas nos balanceamentos da reação acima.
I. Átomos de dois elementos diferentes podem possuir afinidades iguais por elétrons. II. A ligação H - Cl possui carga parcial negativa no átomo de cloro. III. Espera-se que a molécula de HF tenha uma maior polaridade que a molécula de HCl. IV. Em ligações do tipo covalente pura, há uma completa transferência de elétrons de um átomo para outro.
Assinale a alternativa que contém as afirmações verdadeiras:
Em condições ideais, pequenas quantidades de gás cloro podem ser geradas em laboratório pela reação do óxido de manganês (MnO2 ) com ácido clorídrico (HCl), conforme a equação química a seguir não balanceada.
HCl(aq) + MnO2 (s) → H2O(L) + MnCl2(s) + Cl2(g)
A partir dessas informações, quantas moléculas de gás cloro, aproximadamente, podem ser produzidas quando 10 g de óxido de manganês com grau de pureza de 87% são colocados para reagir completamente com excesso de ácido clorídrico?
Dado: Número de Avogadro (N) = 6 x 1023
Com relação às ligações químicas (iônica ou covalente), foram feitas as proposições listadas a seguir.
I. A carga de um átomo é uma característica importante na definição do tipo de ligação, uma vez que quanto maior a carga de um átomo, maior a chance de ele formar uma estrutura iônica.
II. O tamanho de um átomo é uma característica importante na definição do tipo de ligação, uma vez que é mais fácil distribuir a nuvem eletrônica ao redor de átomos com tamanhos semelhantes.
III. Quando um par de elétrons de uma ligação é atraído simultaneamente por dois núcleos atômicos temse uma ligação covalente.
IV. Quando dois átomos possuem baixa energia de ionização, a ligação entre eles será iônica.
Está correto apenas o que se afirma em:
Com relação à química, coloque verdadeiro (V) ou (F) nas afirmativas abaixo, a seguir, a opção correta.
( ) Compostos moleculares são formados por meio de ligações metálicas.
( ) Uma substância formada pela ligação entre um metal e um ametal é iônica.
( ) Na tabela periódica, elementos presentes na coluna 17 tendem a receber elétrons, enquanto que os presentes na coluna 1 tendem a doar elétrons.
( ) A tabela periódica atual foi organizada baseada no número atômico dos elementos.
( ) Os gases nobres são elementos que reagem facilmente com qualquer outro elemento.
( ) Um elemento X- e um elemento Y2+ formarão um composto iônico X2Y.
O etanoi é um combustível obtido a partir de fontes renováveis, e cuja equação de combustão a 25°C é a seguinte:
C2H5OH(I) + 3O2(g) → 2CO2(g) + 3H2O(I) ΔH298 =-1368 kJ/mol
Sabendo-se que um volume de 8,05 litros de etanol foi queimado, a quantidade total de calor liberado, em kJ, na combustão acima é:
Dado: densidade do etanoi = 0,8 g/cm3
analise a reação abaixo, com a sua respectiva equação de velocidade:
NO2(g) + CO(g) → NO(g) + CO2(g) v = kr [NO2]2
Os valores da ordem da reação acima em relação ao NO2,
ao CO, e à Ordem Global são, respectiva mente:
O número atômico (Z) e o número de massa (A) de um íon
+
monoatômico com carga 3 que contém 10 elétrons e 14 nêutrons são, respectivamente:
Com relação à aparelhagem comum e técnicas básicas de laboratório, assinale a opção que preenche corretamente as lacunas das sentenças abaixo.
I- Após a limpeza de uma balança analítica, o uso dessa balança deve ser,________.
II- A câmara da balança analítica deve ser mantida fechada durante a pesagem para evitar_________.
III- Para se pesar substâncias sólidas, deve-se usar preferencialmente______ .
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Aminoácidos são compostos orgânicos que contêm um grupo amina e um grupo carboxílico. Nos α-aminoácidos, os dois grupos encontram-se nas extremidades da molécula e entre eles há um átomo de carbono, denominado carbono-α, que também está ligado a um grupo R, conforme a figura.
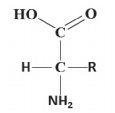
Considere os seguintes aminoácidos:
I. Alanina, em que R = CH3.
II. Asparagina, em que R = CH2CONH2.
III. Fenilalanina, em que R = CH2C6H5.
IV. Glicina, em que R = H.
V. Serina, em que R = CH2OH.
Assinale a opção que contém o(s) aminoácido(s) que possui(em) grupo(s) R polar(es).