Questões Militares Comentadas sobre química
Foram encontradas 976 questões
A chuva ácida é um fenômeno químico resultante do contato entre o vapor de água existente no ar, o dióxido de enxofre e os óxidos de nitrogênio. O enxofre é liberado, principalmente, por veículos movidos a combustível fóssil; os óxidos de nitrogênio, por fertilizantes. Ambos reagem com o vapor de água, originando, respectivamente, os ácidos sulfuroso, sulfídrico, sulfúrico e nítrico.
Assinale a opção que apresenta, respectivamente, a fórmula desses ácidos.
Correlacione os métodos automatizados de titulação às suas respectivas descrições conceituais. Em seguida, assinale a opção que apresenta a sequência correta.
MÉTODO AUTOMÁTICO
I - TITULAÇÃO AMPEROMÉTRICA
II - TITULAÇÃO COULOMÉTRICA
III- TITULAÇÃO IODOMÉTRICA
IV - TITULAÇÃO POTENCIOMÉTRICA
CONCEITO
( ) Ocorre pela medida da diferença de potencial entre um eletrodo indicador e um eletrodo de referência.
( ) Ocorre pela medida da corrente que passa, sob força eletromotriz conveniente , através da célula de titulação entre um eletrodo indicador e um eletrodo de referência despolarizado.
( ) Ocorre pela revelação do titulante
por eletrólise.
Um elemento químico teórico M tem massa atômica igual a 24,31 u e apresenta os isótopos 24M, 25M e 26M. Considerando os números de massa dos isótopos iguais às massas atômicas e sabendo-se que a ocorrência do isótopo 25 é de 10,00%, a ocorrência do isótopo 26 é
Analise as afirmações I, II, III e IV abaixo referente(s) à(s) característica(s) e/ou informação(ões) sobre algumas substâncias, nas condições ambientes:
I- A substância é a principal componente do sal de cozinha e pode ser obtida pela evaporação da água do mar. Dentre seus muitos usos podemos citar: a produção de soda cáustica e a conservação de carnes.
II- A substância é classificada como composta, e pode fazer parte da chuva ácida. Dentre seus muitos usos, podemos citar: utilização em baterias de automóveis e na produção de fertilizantes, como o sulfato de amônio.
III-A substância em solução aquosa é vendida em drogarias e utilizada como antisséptico e alvejante. Algumas pessoas utilizam essa substância para clarear pelos e cabelos.
IV-A substância é classificada como simples, tem seu ponto de ebulição igual a -195,8 ºC, é a mais abundante no ar atmoférico e reage com o gás hidrogênio produzindo amônia.
As substâncias que correspondem às afirmações I, II, III e IV são, respectivamente,
Considere os compostos I, II e III a seguir.
Assinale com V as afirmativas verdadeiras e com F as falsas.
( ) Os compostos I e II são isômeros de função.
( ) Os compostos I e III são isômeros de posição.
( ) Os compostos II e III são isômeros de cadeia.
( ) Os compostos I, II e III são isômeros planos.
Assinale a sequência CORRETA.
Quando cortamos uma cebola, a partir de reações químicas é liberada uma substância gasosa (substância A). Esse gás, ao entrar em contato com a água existente nos olhos, provoca uma outra reação química que a transforma em outra substância (substância B), que causa a irritação das terminações nervosas desses órgãos, resultando na sensação de ardência.
A figura a seguir mostra as substâncias A e B, respectivamente.
Considerando as duas substâncias, fizeram-se as seguintes afirmações:
I. Sendo o enxofre o átomo central, as geometrias das substâncias A e B são, respectivamente, linear e tetraédrica.
II. A substância A é solúvel em água porque o par de elétrons não ligante do enxofre favorece o fato de o composto ser polar.
III. A substância B que provoca irritação nos olhos é um ácido forte e uma substância polar.
Estão CORRETAS as afirmativas:
As equações químicas a seguir representam o processo de síntese dos óxidos de bário e alumínio e suas respectivas entalpias de transformação.
2Ba(s) + O2 (g) → 2 BaO(s) ΔHº = –1.107 kJ
2Al(s) + 3/2O2 (g) → Al2 O3 (s) ΔHº = –1.676 kJ
O metal bário é produzido pela reação do metal alumínio com óxido de bário.
A partir dessas informações, a variação da entalpia para a reação de produção do metal bário é igual a:
O resultado da análise laboratorial das amostras de água coletadas no Rio Doce, em Minas Gerais, apontou níveis acima das concentrações aceitáveis de metais pesados na lama que escorreu para o rio com o rompimento das barragens na cidade de Mariana. Com relação ao limite de lançamento de efluente no rio, a concentração de manganês estabelecida pela legislação brasileira é de 1,0 mg/L.
Considerando que em um volume de 100.000 litros da água do rio foram encontrados 6 Kg de manganês,
quantas vezes a concentração de manganês foi superior ao valor estabelecido pela legislação?
O modelo atômico de Bohr contribuiu muito para a implantação do modelo atual. Uma das contribuições foi a proposição de que os elétrons existem apenas em níveis de energia distintos e que são descritos pelos números quânticos. Dentro desse contexto, Bohr inseriu no vocabulário científico a ideia de estados fundamentais e excitados para descrever o comportamento dos elétrons nos átomos.
Considerando essas informações, assinale a alternativa que representa a configuração eletrônica em que o átomo se encontra no estado excitado.
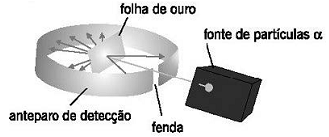
Disponível em:: <http://objetoseducacionais2.mec.gov.br/bitstream/handle/mec/12908/08_avaliacao.htm> . Acesso em: 11 jan. 2016.
Com esse experimento, é possível concluir:
Nos últimos meses, tem-se discutido sobre o uso de uma substância química, a fosfoetanolamina, anunciada como a cura para diversos tipos de cânceres. A estrutura química da fosfoetalonamina é descrita a seguir e tem o fósforo como o átomo central.
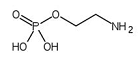
Sobre a estrutura química da fosfoetalonamina, analise as seguintes afirmativas:
I. A geometria molecular da fosfoetanolamina é piramidal.
II. A fosfoetalonamina tem 15 ligações sigma e uma pi.
III. A fosfoetalonamina é um composto covalente polar.
Estão CORRETAS as afirmativas:
Considere que o pH estomacal seja igual a 2. Quando o fármaco ácido acetilsalicílico (AAS) é ingerido, no estômago sofre ionização em meio aquoso, estabelecendo o seguinte equilíbrio:
AAS(s) + H2O(l)  H3O+(aq) + AAS–(aq) ΔH < 0
H3O+(aq) + AAS–(aq) ΔH < 0
Nessas condições, é CORRETO afirmar que a ionização do AAS é:
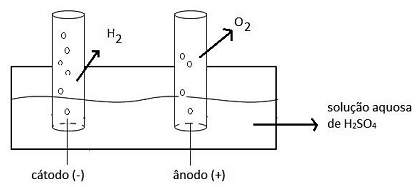
Com relação ao experimento, dentre as substâncias iniciais e as que foram formadas no processo de eletrólise da água, são consideradas substância simples, composta e mistura, respectivamente:
Em 2012, uma carreta carregada com ácido sulfúrico (H2 SO4 ) tombou na Br-381. Sabe-se que o ácido sulfúrico tem as seguintes propriedades:

Considerando que nesse acidente o derramamento de ácido foi de 20 mil litros, qual a massa, em gramas,
aproximada de bicarbonato de sódio (NaHCO3
) necessária para neutralizar totalmente o ácido?
A cocaína, a efedrina e a anfetamina têm restrição total de uso, pois elas causam diversas alterações comportamentais, elevando os riscos de infarto agudo do miocárdio.
Observe as figuras a seguir que correspondem às fórmulas estruturais da cocaína, da efedrina e da anfetamina, respectivamente.
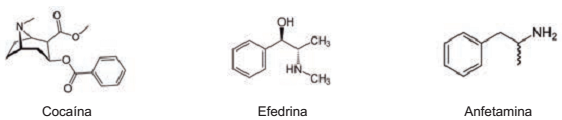
Sobre as drogas citadas, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) Nas três estruturas, identifica-se em comum seis carbonos insaturados.
( ) Nas três estruturas, identifica-se em comum apenas um centro quiral.
( ) Na cocaína e na efedrina, identificam-se em comum mais de um carbono primário.
( ) Na efedrina e na anfetamina, identifica-se em comum uma amina primária.
Assinale a sequência CORRETA.
O rótulo de uma garrafa de água mineral apresenta a seguinte descrição:
COMPOSIÇÃO QUÍMICA PROVÁVEL (mg/L): bicarbonato de bário = 0,38; bicarbonato de estrôncio = 0,03; bicarbonato de cálcio = 66,33; bicarbonato de magnésio = 50,18; bicarbonato de potássio = 2,05; bicarbonato de sódio = 3,04; nitrato de sódio = 0,82; cloreto de sódio = 0,35.
CARACTERÍSTICAS FÍSICO-QUÍMICAS: pH medido a 25 °C = 7,8; temperatura da água na fonte = 18 °C; condutividade elétrica a 25 °C = 1,45·10-4 mhos/cm; resíduo de evaporação a 180 °C = 85,00 mg/L; radioatividade na fonte a 20 °C e 760 mm Hg = 15,64 maches.
A respeito da água mineral citada, de sua composição e características, são feitas as seguintes afirmativas:
I – esta água apresenta caráter básico nas condições citadas.
II – a água mineral citada pode ser classificada como uma solução, em razão da presença de substâncias dissolvidas.
III – todas as substâncias químicas presentes na composição provável apresentada são da função inorgânica Sal.