Questões Militares Comentadas sobre química
Foram encontradas 976 questões
Das afirmativas apresentadas está(ão) correta(as)

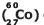 é muito utilizado na esterilização de alimentos, no processo a frio. Seus derivados são empregados na confecção de esmaltes, materiais cerâmicos, catalisadores na indústria petrolífera nos processos de hidrodessulfuração e reforma catalítica. Sabe-se que este radioisótopo possui uma meia-vida de 5,3 anos. Considerando os anos com o mesmo número de dias e uma amostra inicial de 100 g de cobalto-60, após um período de 21,2 anos, a massa restante desse radioisótopo será de
é muito utilizado na esterilização de alimentos, no processo a frio. Seus derivados são empregados na confecção de esmaltes, materiais cerâmicos, catalisadores na indústria petrolífera nos processos de hidrodessulfuração e reforma catalítica. Sabe-se que este radioisótopo possui uma meia-vida de 5,3 anos. Considerando os anos com o mesmo número de dias e uma amostra inicial de 100 g de cobalto-60, após um período de 21,2 anos, a massa restante desse radioisótopo será de Dados: massas atômicas: C = 12 u ; O = 16 u ; H = 1 u
Das afirmativas apresentadas estão corretas apenas
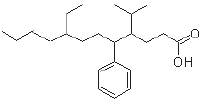
O nome dos substituintes orgânicos ligados respectivamente aos carbonos de número 4, 5 e 8 da cadeia principal, são
Dados: massa molar da nitroglicerina = 227 g/mol; volume molar = 24,5 L/mol (25 ºC e 1 atm)
4C(S) + S8(S) → 4 CS2(1) ΔH = + 358,8 kJ
Se o calor absorvido durante a reação foi de 3588 kj, quantos mols de CS2 foram produzidos?
2NO (g) + O2(g),→ 2NO2(g) ΔH = ?
Qual o valor da entalpia padrão da reação acima?
Dados:
N2(g) + O2(g) → 2NO(g) ΔH = +180,5 kJ
N2(g) + 2O2(g) → 2NO2(g) ΔH = + 66,4 kJ
A velocidade de uma reação química a uma temperatura constante é proporcional ao produto das concentrações das substâncias reagentes.
A definição acima é atribuída à lei
Dados: Kw = [H30+] [OH- ] = 10-14 Ba(OH)2(s) → Ba+2(aq) + 20H-(aq)
