Questões Militares Comentadas sobre química
Foram encontradas 976 questões
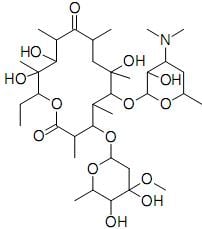
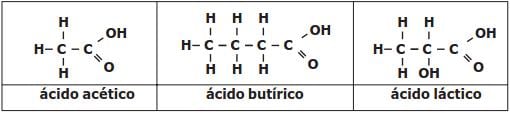
Com relação a estas substâncias citadas, são feitas as afirmativas abaixo.
I – Ácido Acético é a nomenclatura usual do composto que, segundo a nomenclatura oficial da União Internacional de Química Pura e Aplicada (IUPAC), é denominado de ácido metanóico.
II – As substâncias apresentadas possuem na estrutura grupos que caracterizam a função química ácido carboxílico.
III – O motivo de o ácido láctico apresentar maior ponto de fusão que o ácido butírico pode ser atribuído aos fatos de o ácido láctico ter maior massa molecular e de ser capaz de estabelecer maior número de fortes interações intermoleculares.
Dados:
- massas atômicas: C = 12 u ; H = 1 u; O = 16 u
Das afirmativas apresentadas está(ão) correta(s)
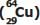 é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação
é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação  .
. Considerando uma amostra inicial de 128 mg de cobre-64, após 76,8 horas, a massa restante desse radioisótopo será de:
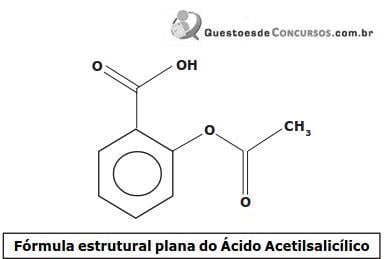
Considerando a fórmula estrutural plana simplificada do AAS, a alternativa que apresenta corretamente a fórmula molecular do composto e os grupos funcionais orgânicos presentes na estrutura é:
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
Dados:
Energia de Ligação
C = O 745 kJ/mol
C
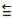 O 1080 kJ/mol
O 1080 kJ/mol C - Cl 328 kJ/mol
Cl - Cl 243 kJ/mol
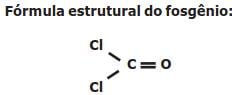
Ponto de ebulição dos hidretos do grupo 4A e 6A em função da massa molecular.
(Química Ciência Central.)
Sobre a imagem e intensidade das forças intermoleculares, analise.
I. No geral, o ponto de ebulição de compostos de hidrogênio torna-se maior com o aumento da massa molecular, devido ao acréscimo das forças de dispersão.
II. Os compostos NH3 e HF também têm pontos de ebulição altos.
III. A ligação de hidrogênio é um tipo de atração intermolecular entre o átomo de hidrogênio em uma ligação apolar (particularmente uma ligação com F, O ou N) e um par de elétrons não compartilhado em um íon ou átomo pequeno e eletronegativo que esteja próximo (geralmente um átomo de F, O ou N em outra molécula).
Está(ão) correta(s) apenas a(s) afirmativa(s)
( ) Ao adicionar solução de fenolftaleína em um meio ácido a solução ficará incolor, pois o aumento da concentração de H+ desloca o equilíbrio.
( ) O ácido carbônico é um ácido fraco, extremamente instável, que se forma somente em equilíbrio dinâmico entre a água e o gás carbônico.
( ) Quando reagem com o zinco produzem hidrogênio gasoso.
( ) Reagem com carbonatos e bicarbonatos para produzir monóxido de carbono.
A sequência está correta em
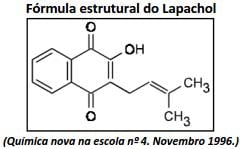
A partir da fórmula estrutural do lapachol, analise as afirmativas.
I. Possui massa molar de, aproximadamente, 242 g/mol.
II. Possui fórmula molecular C15H14O3.
III. Possui em sua estrutura as funções orgânicas fenol e éster.
Está(ão) correta(s) apenas a(s) afirmativa(s)