Questões Militares Comentadas sobre química
Foram encontradas 744 questões
Observe a figura a seguir:
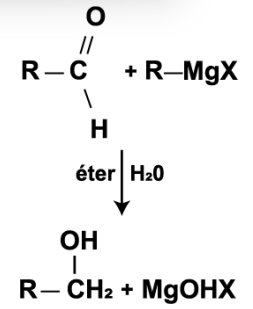
Figura. Reação genérica entre um composto de Grignard com um aldeído, na presença de éter e água.
Considerando R, uma cadeia com 3 carbonos e X, o cloro (Cl), assinale a alternativa que apresenta quais seriam os nomes do álcool e do sal básico formados, respectivamente.
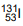 radioativo foi empregado pela primeira vez em 1941 no Massachusetts General Hospital, quando Hertz e Roberts trataram pacientes com hipertireoidismo. Dependendo da dose de iodo radioativo administrada, pode ser necessária a internação do
paciente, geralmente em um quarto especial para impedir que outras pessoas sejam expostas à radiação. O isótopo
radioativo foi empregado pela primeira vez em 1941 no Massachusetts General Hospital, quando Hertz e Roberts trataram pacientes com hipertireoidismo. Dependendo da dose de iodo radioativo administrada, pode ser necessária a internação do
paciente, geralmente em um quarto especial para impedir que outras pessoas sejam expostas à radiação. O isótopo 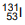 possui
possui O elemento químico mais eletronegativo, localizado no grupo 17 e no segundo período da Tabela Periódica, tende a formar I de carga II para ficar mais estável e, nessa configuração, sua última camada eletrônica possui III elétrons.
Esse elemento se associa ao hidrogênio, formando uma substância que pode ser usada para criar situações de destruição em massa, uma vez que produz efeitos sistêmicos decorrentes da hipocalcemia, hipomagnesemia e hiperpotassemia, além da possível ocorrência de coagulopatia e arritmias cardíacas fatais. (Disponível em: https://www.msdmanuals.com/pt-br. Adaptado)
Completam, correta e respectivamente, as lacunas I, II e III:
2 C4H10 (g) + 13 O2(g) → 8 CO2(g) + 10 H2O(g)
Nessa reação, a variação do número de oxidação do átomo de oxigênio é
2. HCOONa + H2SO4 → 2HCOOH + Na2SO4
Uma solução aquosa foi preparada a partir da dissolução de 6,8 g de metanoato de sódio em 100 ml de água. Essa solução preparada reagiu com uma solução de ácido sulfúrico com centração de 0,2 mol/L para formação do ácido fórmico. Sabendo que a quantidade de solução de ácido sulfúrico foi a quantidade estequiométrica para completar a reação de síntese, a concentração da solução de metanoato de sódio preparada e a quantidade de solução de ácido sulfúrico adicionada, respectivamente, foram:
Massa molar: Na=23 g/mol; C=12 g/mol; O=12 g/mol; O=16 g/mol; H=1 g/mol
Dados – M (g mol-1 ): H = 1; C = 12; N = 14; O = 16.
Qual é o valor da massa molar (em g mol-1 ) desse composto?
A tabela a seguir apresenta algumas informações a respeito de alguns ácidos graxos.
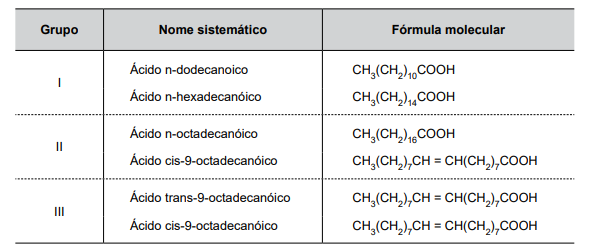
Dentro de cada grupo, I, II e III, os ácidos graxos que apresentam os pontos de fusão mais altos são, correta e respectivamente:
Uma mistura de fenilamina, a anilina, C6 H7N, e fenilmetanol, o álcool benzílico, C7H8O, foi submetida a um procedimento para separação, conforme representado no esquema da figura a seguir.
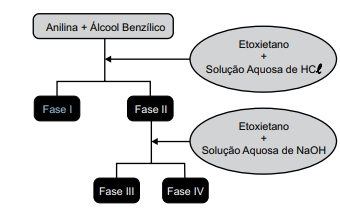
O álcool benzílico e um sal de amina estão presentes,
preponderante e respectivamente, nas fases
O composto orgânico oxigenado, X, reage, em condições adequadas, de acordo com as equações de reação representadas a seguir.
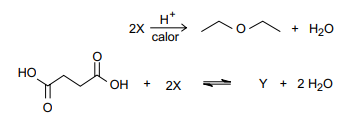
O composto Y tem a seguinte fórmula molecular:
Foram misturados sob agitação Ag2S sólido e uma solução de saturada de H2S (0,1 mol/L) em H+ (0,15 mol/L).
Considerem-se as constantes de equilíbrio a 25 ºC:
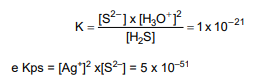
Nessa temperatura, ao se atingir o equilíbrio, a concentração de íons Ag+ na solução será:
Os dados do estudo cinético de uma reação representada por
2 A → 2B + 3C
possibilitaram construção de uma curva de rapidez da reação, representada na figura a seguir.
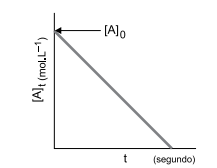
(P. Atkins; L. Jones; Princípios de Química: questionando a vida
moderna e o meio ambiente. 5a
ed. Trad. Ricardo Bicca de Alencastro.
Porto Alegre: Bookman, 2012. Adaptado)
A ordem dessa reação e as unidades de sua constante
de velocidade são:
Considere as seguintes representações de equações de reação:
I. A (g) + B (g) → AB (s) ΔHo > 0
II. C (l) + D (s) → CD (g) ΔHo > 0
A respeito da espontaneidade dessas reações, é correto afirmar que
A reação da amônia com oxigênio pode ocorrer sob condições adequadas, de acordo com a equação a seguir.
Equação 1
2 NH3(g) + 3/2 O2(g) → N2(g) + 3 H2O(g)
Considere as seguintes equações termoquímicas envolvendo a amônia:
2 NH3(g) + 7/2 O2(g) → 2 NO2(g) + 3 H2O(g) ΔHo = –566 kJ
3 NO2(g) + 4 NH3(g) → 7/2 N2(g) + 6 H2O(g) ΔHo = –1370 kJ
A entalpia da reação da combustão de um mol de amônia representada na equação 1 é igual a, aproximadamente
Em uma aula prática de química, foi montada a aparelhagem representada na figura a seguir, para um experimento de eletrólise, usando-se como eletrólito, uma solução aquosa de iodeto de sódio 1,0 mol/L em pH = 7 e algumas gotas de uma solução aquosa de amido.
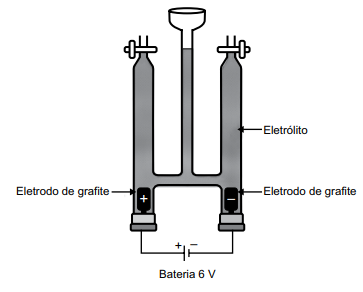
Dados: potencial padrão de redução a 25 ºC.
O2(g) + H2O(l) + 4e–
→ 4OH–(aq) Eo
= +0,40 V
I2(s) + 2 e– → 2 I– (aq) Eo = +0,54 V
O2(g) + 4 H+(aq) + 4e– → 2 H2O(l) Eo = +1,23 V
2 H2O (l) + 2e– → H2(g) + 2OH– (aq) Eo = –0,83 V
Na+(aq) + 1e– → Na(s) Eo = –2,71 V
(P. Atkins, P.; L. Jones; Princípios de Química: questionando a vida
moderna e o meio ambiente. 5ª ed. Porto Alegre: Bookman, 2012)
Ao iniciar o experimento, verificou-se o sugimento de
coloração azulada em um dos compartimentos eletródicos e a formação de um gás no outro compartimento.
Esse fato ocorreu devido à formação de iodo no
A bateria de Thomas Edison desenvolvida no século 19 é um dispositivo eletroquímico que funciona de acordo com o esquema simplificado representado na figura. No sentido da descarga, o potencial fornecido por par de eletrodos é igual a +1,35V
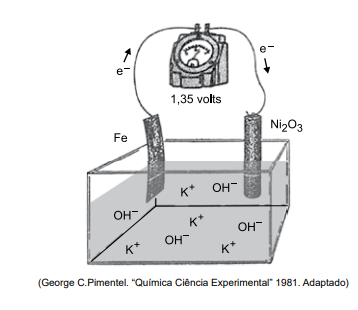
Considere as informações:
Semirreação Potencial padrão de redução (Eº)
I. Fe(OH)2 (s) + 2e– → Fe(s) + 2OH– (aq) X
II. Ni2O3(s) + 3H2O (l) + 2e– → 2Ni(OH)2(s) + 2OH–
(aq) +0,48V
Na bateria de Thomas Edison em operação no sentido da descarga, o eletrodo em que se processam a oxidação e o
potencial padrão de redução da equação I são:
Uma solução aquosa de cianeto de sódio foi adicionada a uma solução aquosa de permanganato de potássio, em meio básico. Assim, foram formados o óxido de manganês (IV) sólido e o íon cianato, CNO– .
Na semirreação envolvendo um mol do íon cianeto há a participação de ________ elétrons.
No balanceamento da equação global da reação envolvendo 2 mol do íon permanganato, participam _______ de íons hidroxila representados no lado dos _______ da equação de reação.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
Considere os seguintes pares de compostos:
I. HF e HI
II. NH3 e H2O
III. C2 H2 e C2 H4
Os compostos que apresentam maior acidez (menor valor de pKa) em I, II e III são, correta e respectivamente: