Questões Militares
Comentadas sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 16 questões
Dois cilindros mantidos sob a mesma temperatura contêm gases puros, sendo ozônio no cilindro 1 e dióxido de enxofre no cilindro 2. A capacidade volumétrica do cilindro 2 é igual à metade da capacidade volumétrica do cilindro 1. Os dois gases estão sob a mesma pressão.
A relação entre a massa de gás do cilindro 1 e a massa de gás do cilindro 2 é igual a:
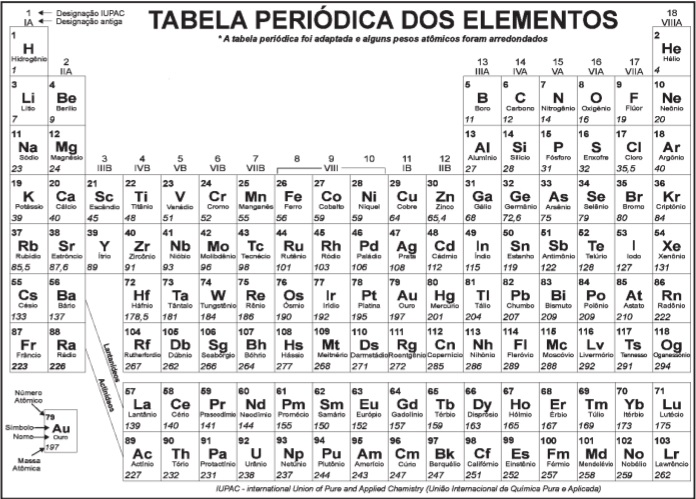
O gás nitrogênio (N2) é o que se encontra em maior proporção no ar atmosférico. Por ser considerado um gás inerte, ele pode estar presente em diversos processos laboratoriais e industriais. Sua obtenção é feita através da liquefação fracionada do ar atmosférico. Supondo que, a partir desse processo, obteve-se uma amostra de 280g desse gás, é correto afirmar que o volume ocupado por ele sob condições normais de temperatura e pressão foi de
Dado: MMN = 14 g/mol
Qual a massa de nitrogênio, em kg?
Gases apresentam um fenômeno chamado de difusão de gases.
“Difusão gasosa é o movimento espontâneo das partículas de um gás de se espalharem uniformemente em meio das partículas de um outro gás ou de atravessarem uma parede porosa.
Quando gases diferentes (A e B) estão a uma mesma temperatura, para uma quantidade de matéria igual a 1 mol de gás A e 1 mol de gás B, tem-se que a massa do gás A (ma) será igual à massa molar do gás A (Ma), e a massa do gás B (mb) será igual à massa molar do gás B (Mb).”
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007,
Pág. 110
Considere que, em determinadas condições de temperatura e pressão, a velocidade de difusão de 1 mol do gás hidrogênio (H2) seja de 28 km/min. Nestas mesmas condições a velocidade (em km/h) de 1 mol do gás metano (CH4) é de
Dado: √2 = 1,4
Considere os dados apresentados na tabela.

(Bottecchia, O.L. Química Nova. Adaptado)
Considerando que a massa molar do ar em toda a atmosfera é aproximadamente constante, 29 g.mol–1
, o valor
da pressão atmosférica na mesosfera, X, na temperatura
indicada na tabela é aproximadamente
“Houston, temos um problema” - Esta frase retrata um fato marcante na história das viagens espaciais, o acidente com o veículo espacial Apollo 13. Uma explosão em um dos tanques de oxigênio da nave causou a destruição parcial do veículo, obrigando os astronautas a abandonarem o módulo de comando e ocuparem o módulo lunar, demovendo-os do sonho de pisar na lua nessa missão espacial.
Não foram poucos os problemas enfrentados pelos astronautas nessa missão. Um específico referiu-se ao acúmulo de gás carbônico (dióxido de carbono - CO2) exalado pelos astronautas no interior do módulo lunar. No fato, os astronautas tiveram que improvisar um filtro com formato diferente do usado comumente no módulo. Veículos espaciais são dotados de filtros que possuem hidróxidos que reagem e neutralizam o gás carbônico exalado pelos tripulantes. Para neutralização do gás carbônico, o hidróxido mais utilizado em veículos espaciais é o hidróxido de lítio. Em sua reação com o dióxido de carbono, o hidróxido de lítio forma carbonato de lítio sólido e água líquida.
Considerando o volume de 246 L de gás carbônico produzido pelos astronautas (a 27 ºC e 1 atm), a massa de hidróxido de lítio necessária para reagir totalmente com esse gás é de
Dados: R = 0,082 atm·L·mol-1·K-1
T (Kelvin) = t (Celsius) + 273
Um analista químico realizou um experimento em que utilizou 200 mL de uma solução de concentração 2 mol/L de ácido clorídrico (HCl) para reagir com uma certa massa de bicarbonato de sódio (também denominado de hidrogenocarbonato de sódio). Notou que nem todo o ácido reagiu com essa massa de bicarbonato de sódio, restando um excesso de ácido. Ao final do experimento, ele obteve um volume de 6,15 L de gás carbônico, medidos a 27 ºC e 1 atm. Esse gás carbônico é oriundo da decomposição do ácido carbônico produzido na reação.
Dados: R = 0,082 atm·L·mol-1·K-1
T (Kelvin) = t (Celsius) + 273
Esse analista fez as seguintes afirmativas:
I – A equação química balanceada que descreve corretamente a reação citada é:
Na2CO3 + 2 HCl → H2CO3 + 2 NaCl
II – Para a formação de 6,15 L de CO2, foram consumidos 21 g de bicarbonato de sódio.
III – É uma reação de oxidorredução e o ácido clorídrico é o agente oxidante.
IV – Se todo esse ácido clorídrico fosse consumido numa reação completa com bicarbonato de sódio suficiente, o volume de gás carbônico produzido seria de 9,84 L.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Dados: massa atômica de cobre 64 u ; volume molar nas CNTP: 22,7 L
Em muitos aspectos, os gases são a forma de matéria mais facilmente entendida. Ainda que diferentes gases possam ter diferentes propriedades químicas, eles se comportam de maneira bastante similar no que concerne às propriedades físicas. De acordo com o exposto, analise as afirmativas a seguir.
I. A densidade do vapor de tetracloreto de carbono a 714 torr e 125°C é 4,43 g/L.
II. A razão entre as taxas de efusão de N2 e O2 é 0,93.
III. A velocidade vqm, u, de uma molécula de N2 a 25°C é 5,15 x 102 m/s.
Está(ão) correta(s) apenas a(s) afirmativa(s)
Dados: massa molar da nitroglicerina = 227 g/mol; volume molar = 24,5 L/mol (25 ºC e 1 atm)
“Gelo de fogo” escondido em permafrost é fonte de energia do futuro? Conhecido como "gelo que arde", o hidrato de metano consiste em cristais de gelo com gás preso em seu interior. Eles são formados a partir de uma combinação de temperaturas baixas e pressão elevada e são encontrados no limite das plataformas continentais, onde o leito marinho entra em súbito declive até chegar ao fundo do oceano. Acredita-se que as reservas dessa substância sejam gigantescas. A estimativa é de que haja mais energia armazenada em hidrato de metano do que na soma de todo petróleo, gás e carvão do mundo. Ao reduzir a pressão ou elevar a temperatura, a substância simplesmente se quebra em água e metano – muito metano. Um metro cúbico do composto libera cerca de 160 metros cúbicos de gás a pressão e temperatura ambiente, o que o torna uma fonte de energia altamente intensiva.
Disponível em: http://www.bbc.co.uk/portuguese/noticias/2014/04/140421_energia_metano_ms.shtml.
Acessado em 21/04/2014. Texto adaptado.
Dado: R = 8,2 x 10-5 m3 atm K-1 mol-1
Para armazenar todo o gás do interior de 1 m3 de “gelo de fogo” num cilindro de 1 m3 e a temperatura de 0°C, é necessária uma pressão (em atm) de

Com base nessas informações e considerando
 a variação de
a variação deentalpia padrão das reações a 25 ºC, julgue os itens a seguir.