Questões Militares
Comentadas sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 89 questões
“Solução saturada: solução que contém a quantidade máxima de soluto em determinada quantidade de solvente, a determinada temperatura; a relação entre quantidades máximas de soluto e quantidade de solvente é denominada de coeficiente de solubilidade”.
“Solução insaturada: quando a solução contém uma quantidade de soluto inferior ao seu coeficiente de solubilidade, na temperatura em que se encontra a solução”.
“Solução supersaturada: quando a solução contém uma quantidade de soluto dissolvido superior ao seu coeficiente de solubilidade, na temperatura em que se ela se encontra. É instável” .
USBERCO, João e SALVADOR, Edgard, Físico-química, São Paulo, Ed Saraiva, 2009, Pág. 18
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 18 e 19.
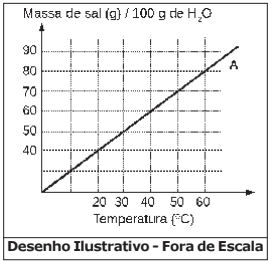
Considere o gráfico da curva de solubilidade em função da temperatura para um sal hipotético A. No gráfico, a linha contínua representa a solubilidade máxima do soluto (sal A) em 100 g de água na temperatura correspondente.
Acerca desse gráfico e processo de solubilidade são feitas as seguintes afirmativas:
I – Na temperatura de 20 ºC, misturando-se 50 g do sal A em 100 g de água, ter-se-á um sistema heterogêneo.
II – Na temperatura de 40 ºC, a adição de 50 g do sal A em 100 g de água produzirá uma solução insaturada.
III – 200 g de água dissolvem totalmente 90 g do sal A a 30 ºC.
IV – Uma solução contendo 60 g do sal A em 100 g de água será saturada em 60 ºC.
Das afirmativas feitas estão corretas apenas
Considere a curva de solubilidade da sacarose.
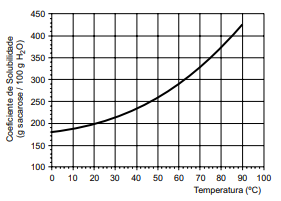
A temperatura em que se iniciou a cristalização e a massa máxima de açúcar cristalizada na solução em repouso a 20 ºC são, correta e respectivamente,
Completou-se o volume do balão com água destilada. Considerando que se empregou a técnica quantitativa na preparação da solução, a concentração de íons nitrato na solução preparada é
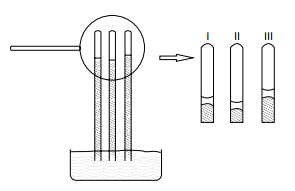
Nesse experimento, a água, a solução de cloreto de sódio e a solução de glicose estão contidas, respectivamente, nos tubos
Considere as figuras I e II abaixo.
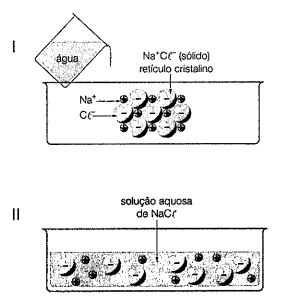
O fenômeno ocorrido na sequência I - II é denominado:
Um litro de uma solução de HCl com pH = 2 deve ser neutralizada com uma solução de NaOH 1 mol.L-1.
O volume, em mL, da solução básica necessário para realizar essa neutralização é igual a
É requerido que fazendas produtoras de leite bovino controlem a acidez do leite que está aguardando o processamento. Essa acidez é resultante da conversão da lactose em ácido lático (ácido 2-hidroxipropanoico) por ação de microrganismos:
C12H22O11 + H2O → 4C3H6O3
Um fazendeiro decidiu fazer um experimento para determinar a taxa de geração de ácido lático no leite armazenado: retirou uma amostra de 50 cm3 de leite, cuja concentração de ácido lático é de 1,8 g/L, e, depois de três horas, utilizou 40 cm3 de uma solução 0,1 molar de NaOH para neutralizá-la.
Conclui-se que a taxa média de produção de ácido lático por litro de leite é:
Observe a reação a seguir:
HCI(aq) + NaOH(aq) → NaCI(aq) + H2O(I)
(Dado: Fe = 56 g.mol-1 ).
Com relação a reações químicas e a substâncias, julgue o item subsequente.
A concentração de uma solução é dada pela quantidade
de matéria por litro de solução.
A soda cáustica é o nome comercial dado ao composto hidróxido de sódio (NaOH). Este composto é largamente aplicado na indústria para a purificação de derivados de petróleo e de óleos vegetais. É também utilizado na fabricação de produtos de uso doméstico, como o sabão.
Dado: MM (NaOH) = 40,00g/mol, qual a concentração em quantidade de matéria de uma solução que foi
preparada dissolvendo-se 200,00g de hidróxido de sódio em água e completando-se para 2,00L de solução?