Questões Militares de Química - Soluções e Substâncias Inorgânicas
Foram encontradas 292 questões

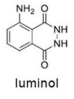
Tendo como referência a estrutura do luminol, apresentada anteriormente, e as informações do texto precedente, julgue o item a seguir, considerando que MH = 1 g/mol, MC = 12 g/mol, MN = 14 g/mol e MO = 16 g/mol.
A água oxigenada, substância utilizada no tratamento do
luminol para detecção de sangue, é classificada como um
peróxido e possui característica apolar.
Um analista precisava neutralizar uma certa quantidade de ácido sulfúrico (H2SO4) de seu laboratório e tinha hidróxido de sódio (NaOH) à disposição para essa neutralização. Ele realizou a mistura de 245 g de ácido sulfúrico com 100 g de hidróxido de sódio e verificou que a massa de um dos reagentes não foi completamente consumida nessa reação. Sabendo-se que o reagente limitante foi completamente consumido, a massa do reagente que sobrou como excesso após a reação de neutralização foi de
Dado: massa atômica do H= 1 u; O= 16 u; Na= 23 u; Cl=35,5 u
Analise as afirmativas a seguir.
I. Ácido é toda substância que doa prótons.
II. Ácido é toda substância que recebe elétrons.
III. Ácido é toda substância que se ioniza em presença de água e origina, como um dos íons, o cátion H+ .
IV. Base é toda substância que recebe elétrons.
V. Base é toda substância que, em solução aquosa, sofre dissociação iônica, liberando o ânion OH– .
VI. Base é toda substância capaz de receber prótons.
Tratam da teoria de Bronsted-Lowry apenas as afirmativas