Questões Militares
Sobre termodinâmica: energia interna, trabalho, energia livre de gibbs e entropia em química
Foram encontradas 14 questões
C5H8N4O12 (s) → 4 H2O (g) + 3 CO2 (g) + 2 N2 (g) + 2 CO (g)
As entalpias padrão de formação (
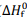 ), a 1 atm e 298 K,
são informadas na tabela a seguir.
), a 1 atm e 298 K,
são informadas na tabela a seguir. 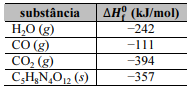
A partir desses dados, é correto concluir que a variação de entalpia para a reação de detonação de PETN, a 1 atm e 298 K, é
Foi adicionada a uma bomba calorimétrica selada, com volume invariável a 25 ºC, uma mistura gasosa de um hidrocarboneto saturado e oxigênio, com pressão total P1 , em proporção estequiométrica para reação de combustão completa.
Após acionada a ignição, a mistura gasosa reagiu completamente. Considerando que o volume do líquido formado na reação é desprezível em relação ao volume total do compartimento e que a pressão P2 no interior da bomba calorimétrica após a reação 25 ºC é igual a 0,5 x P1 , a fórmula molecular do hidrocarboneto empregado no experimento é:
Considere as seguintes representações de equações de reação:
I. A (g) + B (g) → AB (s) ΔHo > 0
II. C (l) + D (s) → CD (g) ΔHo > 0
A respeito da espontaneidade dessas reações, é correto afirmar que
A figura apresenta um diagrama de temperatura-composição de um azeótropo de ponto de ebulição mínimo.
Esse diagrama refere-se a uma mistura de líquidos, tal
como

I. Um processo termodinâmico é definido pelo estado final e estado inicial do sistema.
II. ∆T é sempre nula em um processo isotérmico.
III. A troca de calor envolvida em um processo isotérmico deve ser nula (q = 0).
IV. Todo processo em que ∆T = 0 é um processo isotérmico.
V. ∆T = 0 para todo processo em sistema isolado.
Assinale a opção que contém as afirmações ERRADAS:

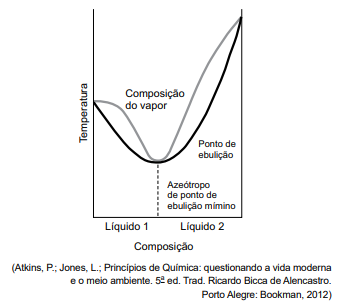
I. O ∆H refere-se à transição de fase do tensoativo.
II. O calor latente de fusão do tensoativo puro é -180 J.g-1.
III. Até 35% em massa de água pode se apresentar na forma associada à substância e não funde. IV. O ∆H é proporcional à quantidade de água não associada ao tensoativo.
Com base no gráfico e nas informações do enunciado, assinale a opção que indica a(s) afirmação(ões) CORRETA(S).
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

I. A entropia permanece constante em um sistema fechado que sofre a ação de um processo reversível. II. A variação de entropia é nula dentro do sistema quando ele opera em um ciclo de Carnot. III. O valor absoluto da variação da energia interna de um gás ideal numa expansão reversível adiabática é maior que numa expansão reversível isotérmica. IV. Energia interna é uma propriedade cuja variação pode ser medida pelo trabalho adiabático realizado entre dois estados.
Das afirmações acima, está(ão) ERRADA(S) apenas
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
Considerando que o saco plástico e o ar em seu interior formam o sistema observado e que o ar comporta-se como um gás ideal, o aluno descreveu as seguintes conclusões: I – Antes de atingir o volume máximo do saco plástico, a variação da energia interna do sistema é nula. II – O trabalho realizado pelo sistema é igual a zero. III – Trata-se de um sistema adiabático. IV – Devido ao aumento do volume do saco plástico, deduz-se que a massa de ar no interior do saco também aumentou.
Julgue se as conclusões do aluno são verdadeiras (V) ou falsas (F) e assinale a alternativa correta:
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
Considere as reações abaixo:
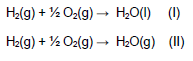
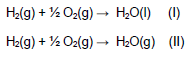
Assinale a alternativa correta.
Considere a expansão de um gás ideal inicialmente contido em um recipiente de 1 L sob pressão de 10 atm. O processo de expansão pode ser realizado de duas maneiras diferentes, ambas à temperatura constante:
I. Expansão em uma etapa, contra a pressão externa constante de 1 atm, levando o volume final do recipiente a 10 L.
II. Expansão em duas etapas: na primeira, o gás expande contra a pressão externa constante de 5 atm até atingir um volume de 2 L; na segunda etapa, o gás expande contra uma pressão constante de 1 atm atingindo o volume final de 10 L.
Com base nestas informações, assinale a proposição CORRETA.