Questões Militares
Comentadas sobre termodinâmica: energia interna, trabalho, energia livre de gibbs e entropia em química
Foram encontradas 10 questões
C5H8N4O12 (s) → 4 H2O (g) + 3 CO2 (g) + 2 N2 (g) + 2 CO (g)
As entalpias padrão de formação (
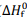 ), a 1 atm e 298 K,
são informadas na tabela a seguir.
), a 1 atm e 298 K,
são informadas na tabela a seguir. 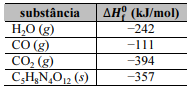
A partir desses dados, é correto concluir que a variação de entalpia para a reação de detonação de PETN, a 1 atm e 298 K, é
Foi adicionada a uma bomba calorimétrica selada, com volume invariável a 25 ºC, uma mistura gasosa de um hidrocarboneto saturado e oxigênio, com pressão total P1 , em proporção estequiométrica para reação de combustão completa.
Após acionada a ignição, a mistura gasosa reagiu completamente. Considerando que o volume do líquido formado na reação é desprezível em relação ao volume total do compartimento e que a pressão P2 no interior da bomba calorimétrica após a reação 25 ºC é igual a 0,5 x P1 , a fórmula molecular do hidrocarboneto empregado no experimento é:
Considere as seguintes representações de equações de reação:
I. A (g) + B (g) → AB (s) ΔHo > 0
II. C (l) + D (s) → CD (g) ΔHo > 0
A respeito da espontaneidade dessas reações, é correto afirmar que
A figura apresenta um diagrama de temperatura-composição de um azeótropo de ponto de ebulição mínimo.
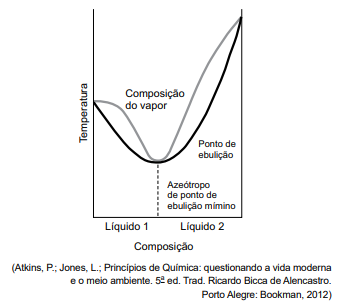
Esse diagrama refere-se a uma mistura de líquidos, tal
como
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
Considere a expansão de um gás ideal inicialmente contido em um recipiente de 1 L sob pressão de 10 atm. O processo de expansão pode ser realizado de duas maneiras diferentes, ambas à temperatura constante:
I. Expansão em uma etapa, contra a pressão externa constante de 1 atm, levando o volume final do recipiente a 10 L.
II. Expansão em duas etapas: na primeira, o gás expande contra a pressão externa constante de 5 atm até atingir um volume de 2 L; na segunda etapa, o gás expande contra uma pressão constante de 1 atm atingindo o volume final de 10 L.
Com base nestas informações, assinale a proposição CORRETA.
Considerando que o saco plástico e o ar em seu interior formam o sistema observado e que o ar comporta-se como um gás ideal, o aluno descreveu as seguintes conclusões: I – Antes de atingir o volume máximo do saco plástico, a variação da energia interna do sistema é nula. II – O trabalho realizado pelo sistema é igual a zero. III – Trata-se de um sistema adiabático. IV – Devido ao aumento do volume do saco plástico, deduz-se que a massa de ar no interior do saco também aumentou.
Julgue se as conclusões do aluno são verdadeiras (V) ou falsas (F) e assinale a alternativa correta: