Questões Militares
Comentadas sobre transformações químicas e energia em química
Foram encontradas 267 questões
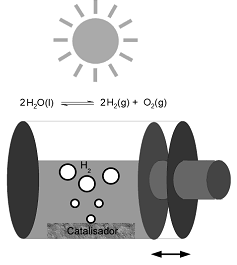
Recentemente, a produção fotocatalítica de hidrogênio vem atraindo atenção devido ao processo que gera um combustível limpo, o qual é utilizado em células a combustível. O processo se baseia na separação da água nos seus componentes, conforme equilíbrio inserido no esquema, utilizando luz solar e um fotocatalisador (p. ex. NaTaO3:La). O processo é extremamente endotérmico, necessitando 1,23 eV para ocorrer. Num experimento, o processo foi realizado num sistema fechado, como esquematizado abaixo. Considerando essas informações, identifique as afirmativas a seguir como verdadeiras (V) ou falsas (F):
( ) A quantidade de fotocatalisador limita a conversão.
( ) O aumento da temperatura irá favorecer a conversão.
( ) A diminuição do volume do sistema irá favorecer a conversão.
( ) É condição necessária para a produção de hidrogênio que o fotocatalisador absorva energia solar superior a 1,23 eV.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Águas termais, exploradas em diversos destinos turísticos, brotam naturalmente em fendas rochosas. O aquecimentonatural dessas águas, na sua grande maioria, deve-se ao calor liberado em processos radioativos de elementospresentes nos minerais rochosos que são transferidos para a água no fluxo pelas fendas. O gás radônio (222Rn) é oprovável responsável pelo aquecimento de diversas águas termais no Brasil. O 222Rn se origina do rádio (226Ra), nasérie do urânio (238U), naturalmente presente em granitos. O tempo de meia vida (t1/2) do 222Rn é de 3,8 dias, e esse seconverte em polônio (218Po), que por sua vez possui um t1/2 de 3,1 minutos. Considerando as informações dadas,considere as seguintes afirmativas:
1. A conversão de 222Rn em 218Po é um processo exotérmico.
2. A conversão de 226Ra em 222Rn emite quatro partículas β-.
3. Na série de decaimento, do 238U ao 218Po, cinco partículas α são emitidas.
4. Após 3,8 dias da extração da água termal, a concentração de 218Po atingirá a metade do valor da concentraçãoinicial de 222Rn.
Assinale a alternativa correta
1a Etapa: o composto A (C7H6O) sofre oxidação em solução básica de permanganato de potássio. O produto gerado, após neutralizado, é o ácido benzoico;
2a Etapa: o ácido benzoico reage com etanol em solução ácida, produzindo o composto B e água;
3a Etapa: o composto B sofre forte redução com hidreto de lítio-alumínio em éter, gerando dois produtos que, depois de neutralizados, formam então o composto C e o etanol.
Considerando as etapas supracitadas, são feitas as seguintes afirmações:
I) o composto A e o composto C são isômeros.
II) o composto B é um éster.
III) o composto B é o acetato de benzila.
Com base na análise das afirmações acima, assinale a opção correta.
As equações que representam as semirreações de cada espécie e os respectivos potenciais- padrão de redução (25 ºC e 1 atm) são apresentadas a seguir.
Zn2+(aq) + 2 e- → Zn (s) Eo = - 0,76 V
Ag+ (aq) + 1 e- → Ag (s) Eo = + 0,80 V
Com base nas informações apresentadas são feitas as afirmativas abaixo.
I – No eletrodo de zinco ocorre o processo químico de oxidação.
II – O cátodo da pilha será o eletrodo de prata.
III – Ocorre o desgaste da placa de zinco devido ao processo químico de redução do zinco.
IV – O sentido espontâneo do processo será Zn+2 + 2 Ago → Zno + 2 Ag+
V – Entre os eletrodos de zinco e prata existe uma diferença de potencial padrão de 1,56 V.
Estão corretas apenas as afirmativas
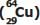 é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação
é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação  .
. Considerando uma amostra inicial de 128 mg de cobre-64, após 76,8 horas, a massa restante desse radioisótopo será de:
O texto a seguir serve como base para a resolução da questão.
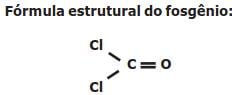
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
Dados:
Energia de Ligação
C = O 745 kJ/mol
C
 O 1080 kJ/mol
O 1080 kJ/mol C - Cl 328 kJ/mol
Cl - Cl 243 kJ/mol
Sobre o incidente do meteoro russo, assinale a alternativa correta:
Sobre a fumaça que anuncia a escolha do papa, assinale a alternativa correta:
Considerando que o saco plástico e o ar em seu interior formam o sistema observado e que o ar comporta-se como um gás ideal, o aluno descreveu as seguintes conclusões: I – Antes de atingir o volume máximo do saco plástico, a variação da energia interna do sistema é nula. II – O trabalho realizado pelo sistema é igual a zero. III – Trata-se de um sistema adiabático. IV – Devido ao aumento do volume do saco plástico, deduz-se que a massa de ar no interior do saco também aumentou.
Julgue se as conclusões do aluno são verdadeiras (V) ou falsas (F) e assinale a alternativa correta:
“Um relatório médico obtido com exclusividade pela redetelevisiva Al Jazeera aponta que foram encontrados níveis de polônio radiativo ao menos 18 vezes acima do normal nos restos mortais do líder palestino Yasser Arafat [...]. O isótopo de Polônio-210 não apresenta risco para a saúde humana se estiver fora do corpo. Caso ingerido ou inalado, mesmo em pequenas quantidades como 0,1 microgramas se tornam fatais”.
Fonte: <http://www1.folha.uol.com.br/mundo/2013/11/1367608-relatorio-de-medico-suicos-aponta-morte-de-yasser-arafat-por-envenenamento.shtml>. Acesso em: 13.março.2014.
Elementos radiativos podem ser bem aplicados,
tais como obtenção de imagens de radiografia,
tratamento de doenças, análises de materiais, usinas
termonucleares, entre outras aplicações. Dos
elementos listados, assinale o elemento que não é
radioativo:
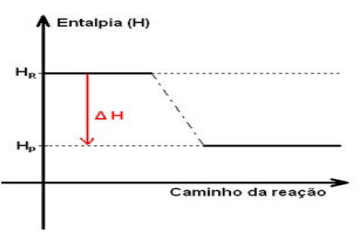
De acordo com o gráfico acima pode concluir se que trata se de uma reação Hp = 250, Hr = 480: I - Espontânea. II - Exotérmica, pois ocorreu um ganho de energia. III - Necessita apenas de um estímulo para que ocorra. IV - Sendo o Hp = 250 kj e Hr = 480kj o delta será de +130 kj. V - Endotérmica, pois ocorreu uma perda de energia. VI - Sendo o Hp = 250 e Hr = 480 delta H será de -130kj. Estão incorretas:
Realiza-se a eletrólise de uma solução aquosa diluída de ácido sulfúrico com eletrodos inertes durante 10 minutos. Determine a corrente elétrica média aplicada, sabendo-se que foram produzidos no catodo 300 mL de hidrogênio, coletados a uma pressão total de 0,54 atm sobre a água, à temperatura de 300 K.
Considere:
• Pressão de vapor da água a 300 K = 0,060 atm;
• Constante de Faraday: 1 F = 96500 C.mol–1;
• Constante universal dos gases perfeitos: R = 0,08 atm.L.K–1.mol–1
.
Considere uma célula a combustível alcalina (hidrogênio-oxigênio) sobre a qual são feitas as seguintes afirmações:
I. Sob condição de consumo de carga elétrica, a voltagem efetiva de serviço desse dispositivo eletroquímico é menor que a força eletromotriz da célula.
II. O combustível (hidrogênio gasoso) é injetado no compartimento do anodo e um fluxo de oxigênio gasoso alimenta o catodo dessa célula eletroquímica.
III. Sendo o potencial padrão dessa célula galvânica igual a 1,229 VEPH (volt na escala padrão do hidrogênio), a variação de energia livre de Gibbs padrão (∆G°) da reação global do sistema redox atuante é igual a − 237,2 kJ ∙ mol−1.
Das afirmações acima, está(ão) CORRETA(S) apenas
São feitas as seguintes afirmações sobre o que Joule demonstrou em seus experimentos do século XIX:
I. A relação entre calor e trabalho é fixa.
II. Existe um equivalente mecânico do calor.
III. O calor pode ser medido.
Das afirmações acima, está(ão) CORRETA(S) apenas
Substância Massa específica (g ∙ cm−3) Calor específico (J ∙ g−1 ∙ K−1)
H2O 1,00 4,18
Ti 4,54 0,52
Cr 7,18 0,45
Ni 8,90 0,44