Questões Militares
Comentadas sobre transformações químicas em química
Foram encontradas 243 questões
Abaixo é mostrada a reação entre essas duas substâncias.
Al2(SO4)3 + 3 Ca(OH)2
 2 Al(OH)3 + 3 CaSO4
2 Al(OH)3 + 3 CaSO4Como pode ser classificada essa reação?
Baseado nessa reação, são feitas as seguintes afirmativas:
I – O sódio atua nessa reação como agente redutor.
II – A soma dos menores coeficientes inteiros que balanceiam corretamente a equação é 7.
III – Os dois produtos podem ser classificados como substâncias simples.
IV – Essa é uma reação de deslocamento.
Das afirmativas feitas, estão corretas:
Hidrogênio - 1 Carbono - 12 Nitrogênio - 14 Oxigênio - 16 Sódio - 23 Enxofre - 32 Cloro - 35,5 Cálcio - 40
CaCO3 → CaO + CO2
Quando a produção de CO2 é de 220g, a produção, em gramas, de CaO é
Hidrogênio - 1 Carbono - 12 Nitrogênio - 14 Oxigênio - 16 Sódio - 23 Enxofre - 32 Cloro - 35,5 Cálcio - 40
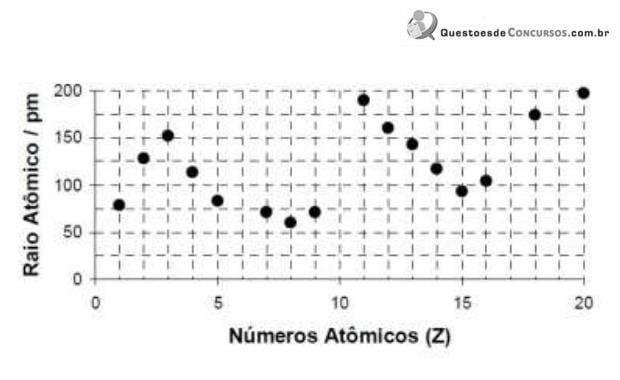
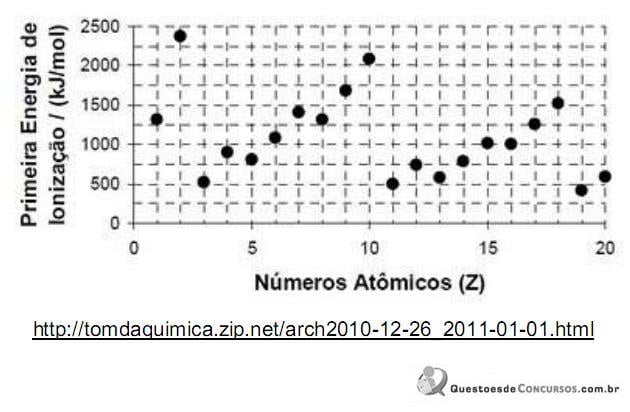
A explicação para o fato de a primeira energia de ionização do elemento sódio ser menor do que a do elemento fósforo é:
Em relação à composição química elementar da madeira, pode-se afirmar que não há diferenças consideráveis, levando-se em conta as madeiras de diversas espécies. Os principais elementos existentes são: Carbono (C)48%, Hidrogênio (H)6%, Oxigênio (O) 44% e Nitrogênio (N) 1%; além destes elementos encontram-se pequenas quantidades de cálcio (Ca), potássio (K), magnésio (Mg) e outros, constituindo as substâncias minerais existentes na madeira.
Em um churrasco realizado por um certo gaúcho, em sua residência, foi consumido 1,7 Kg de madeira para assar toda a carne. Supondo que a combustão do carbono seja completa, a quantidade em matéria (mol) formada de gás carbônico será:
Dados: C=12g/mol.
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.
Com base nessas informações, julgue os itens que se seguem, considerando que as massas molares do N, do H e do O sejam iguais a 14, 1 e 16 g/mol, respectivamente.
A reação de decomposição do NH4NO3 (s) está corretamente balanceada na equação 8NH4NO3 (s) → 4NH3 + 8N2O (g) + 4NO2 (g) + 10H2O (l) + O2 (g).
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Entre os metais citados no texto, aquele que apresenta maior energia de ionização é o alumínio.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
A concepção de átomo proposta por Rutherford permite explicar a coloração da chama emitida no processo de combustão do bário.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
A reação do potássio metálico com água forma dois produtos, um de natureza iônica e outro de natureza molecular, os quais apresentam ligações covalentes em sua estrutura.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Considerando-se o valor aproximado de 6 × 1023 mol -1 para a constante de Avogadro, infere-se que, quando são colocados 1,8 × 1024 átomos de bário e 2 mols de gás oxigênio em reação, formam-se mais de 400 g de BaO.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
O estado de oxidação do bário é mais reduzido na forma metálica desse elemento que na estrutura da substância que resulta como produto de sua queima.