Questões Militares
Comentadas sobre transformações químicas em química
Foram encontradas 243 questões
19X39 20Y54 19Z40 17W37
Assinale a opção em que os átomos são isótopos.
A massa m de um isótopo radioativo que continua ativa em um instante t pode ser determinada pela expressão m = m0e–kt , em que k é a constante de decaimento radioativo, característica do isótopo, e m0, a massa ativa do isótopo no instante t = 0.
no início do ano, foi detectada a contaminação do solo, da água e
até de alimentos com isótopos radioativos, como iodo-131 e césio-
137. Sabendo que o iodo-131 emite radiação beta durante a sua
desintegração e tem meia-vida de 8 dias, julgue o seguinte item.

fundido e que, no processo, além do Na(s), também se forma

julgue o item seguinte.

Com base nessas informações e considerando
 a variação de
a variação deentalpia padrão das reações a 25 ºC, julgue os itens a seguir.

Com base nessas informações e considerando
 a variação de
a variação deentalpia padrão das reações a 25 ºC, julgue os itens a seguir.
I. Obtenção do alumínio a partir da bauxita (Al2O3).
II. Obtenção de aluminio a partir da reciclagem de latinhas.
III. Obtenção de sacos plásticos a partir do eteno.
IV. Obtenção de pregos a partir de material enferrujado.
Dos processos citados, quais são os que representam reações químicas.
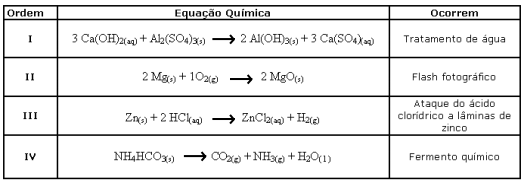
As equações químicas I, II, III e IV correspondem, nessa ordem, aos seguintes tipos de reação:
4 C3H5(NO3)3(l) → 6 N2(g) + 12 CO(g) + 10 H2O(g) + 7 O2(g)
Considerando os gases acima como ideais, a temperatura de 300 Kelvin (K) e a pressão de 1 atm, o volume gasoso total que será produzido na detonação completa de 454 g de C3H5(NO3)3(l) é:
Dados:
Elemento H(hidrogênio) C( carbono) O ( Oxigênio) N( nitrogênio)
Massa 1 12 16 14
atômica(u)
Constante universal dos gases: R=8,2 · 10-2 atm · L · K-1 · mol-1
Be(g) + E1 → Be(g)+ + e-
Mg(g) + E2 → Mg(g)+ + e-
Sr(g) + E3 → Sr(g)+ + e-
Sabendo-se que:
E1 representa o valor da primeira energia de ionização (1ª E.I.) do átomo de Be;
E2 representa o valor da primeira energia de ionização (1ª E.I.) do átomo de Mg;
E3 representa o valor da primeira energia de ionização (1ª E.I.) do átomo de Sr.
Pode-se afirmar que, ocorridas as transformações, a relação entre os valores E1, E2 e E3 será:
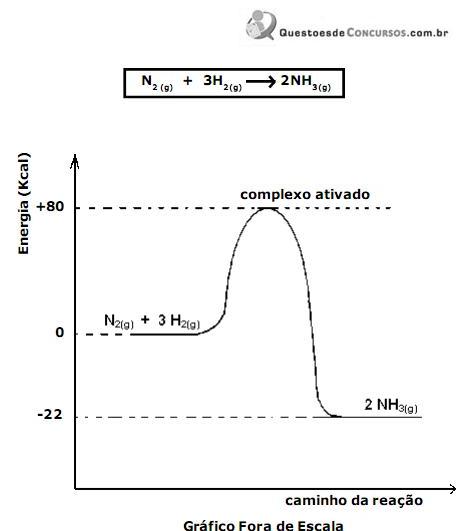
Relativo ao gráfico envolvendo essa reação e suas informações, são feitas as seguintes afirmações:
I - O valor da energia envolvida por um mol de NH3 formado é 22 kcal.
II - O valor da energia de ativação dessa reação é 80 kcal.
III - O processo que envolve a reação N2(g) + 3H2(g) → 2NH3(g) é endotérmico.
Das afirmações feitas, está(ão) correta(s)
Com base na equação da reação química que ocorre no borbulhador, é correto afirmar que o peróxido de hidrogênio atuou no processo como agente oxidante.
Considerando que, na titulação do ácido sulfúrico formado no borbulhador, foram gastos 3,2 mol de NaOH e que o totalizador de volume indicou 4 m3 de amostra de ar, conclui-se que, nessa análise, a concentração de dióxido de enxofre no ar amostrado era de 8 × 10-4 mol / L.
O raio do íon sódio (Na+) é inferior ao do íon potássio (K+).

