Questões Militares
Comentadas sobre transformações químicas em química
Foram encontradas 170 questões
Qual das opções apresenta a equação de uma reação que NÃO acontece pela ação estomacal desse medicamento?
Quanto à ordenação dos elementos na tabela e ao significado da característica que determina sua posição, é correto afirmar que a organização se dá em ordem:
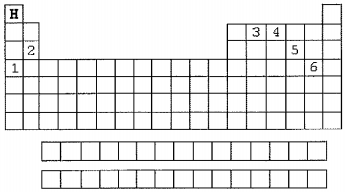
Analise as afirmativas abaixo referentes a esse esboço.
I - O elemento representado por 5 apresenta variantes alotrópicas quando forma moléculas de substâncias compostas.
II - A quantidade de elétrons que o elemento representado por 1 ganha é a mesma que aquele representado por 6 perde quando ambos sofrem ionização.
III- O elemento representado por 3 forma ligações covalentes quando se liga ao hidrogênio.
IV - O elemento indicado por 4 forma a substância simples mais abundante na atmosfera terrestre, e o elemento indicado por 2 faz parte da composição dos ossos humanos.
Assinale a opção correta.
“Gelo de fogo” escondido em permafrost é fonte de energia do futuro? Conhecido como "gelo que arde", o hidrato de metano consiste em cristais de gelo com gás preso em seu interior. Eles são formados a partir de uma combinação de temperaturas baixas e pressão elevada e são encontrados no limite das plataformas continentais, onde o leito marinho entra em súbito declive até chegar ao fundo do oceano. Acredita-se que as reservas dessa substância sejam gigantescas. A estimativa é de que haja mais energia armazenada em hidrato de metano do que na soma de todo petróleo, gás e carvão do mundo. Ao reduzir a pressão ou elevar a temperatura, a substância simplesmente se quebra em água e metano – muito metano. Um metro cúbico do composto libera cerca de 160 metros cúbicos de gás a pressão e temperatura ambiente, o que o torna uma fonte de energia altamente intensiva.
Disponível em: http://www.bbc.co.uk/portuguese/noticias/2014/04/140421_energia_metano_ms.shtml.
Acessado em 21/04/2014. Texto adaptado.
Dado: R = 8,2 x 10-5 m3 atm K-1 mol-1
Para armazenar todo o gás do interior de 1 m3 de “gelo de fogo” num cilindro de 1 m3 e a temperatura de 0°C, é necessária uma pressão (em atm) de
Abaixo é mostrada a reação entre essas duas substâncias.
Al2(SO4)3 + 3 Ca(OH)2
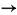 2 Al(OH)3 + 3 CaSO4
2 Al(OH)3 + 3 CaSO4Como pode ser classificada essa reação?
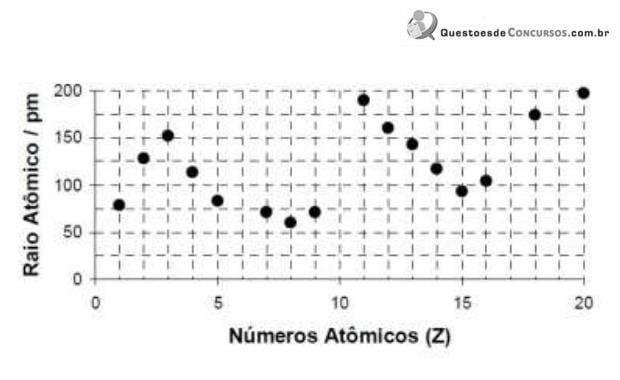
A explicação para o fato de a primeira energia de ionização do elemento sódio ser menor do que a do elemento fósforo é:
Em relação à composição química elementar da madeira, pode-se afirmar que não há diferenças consideráveis, levando-se em conta as madeiras de diversas espécies. Os principais elementos existentes são: Carbono (C)48%, Hidrogênio (H)6%, Oxigênio (O) 44% e Nitrogênio (N) 1%; além destes elementos encontram-se pequenas quantidades de cálcio (Ca), potássio (K), magnésio (Mg) e outros, constituindo as substâncias minerais existentes na madeira.
Em um churrasco realizado por um certo gaúcho, em sua residência, foi consumido 1,7 Kg de madeira para assar toda a carne. Supondo que a combustão do carbono seja completa, a quantidade em matéria (mol) formada de gás carbônico será:
Dados: C=12g/mol.
no início do ano, foi detectada a contaminação do solo, da água e
até de alimentos com isótopos radioativos, como iodo-131 e césio-
137. Sabendo que o iodo-131 emite radiação beta durante a sua
desintegração e tem meia-vida de 8 dias, julgue o seguinte item.

fundido e que, no processo, além do Na(s), também se forma

julgue o item seguinte.