Questões Militares
Comentadas sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 23 questões
I. Amaciamento de carne pela adição de papaína. II. Conservação de frutas em geladeira. III. Antiácido efervescente em pó colocado na água.
Os fatores que alteram a rapidez das reações nas situações I, II e III são, respectivamente,
Considere a reação a seguir:
2 NO + 2 H2 → N2 + 2 H2 O
A lei da velocidade para a reação é de segunda ordem
para o NO e de primeira ordem para o H2
. Portanto, ao
dobrar a concentração de NO mantendo-se a concentração de H2
, a velocidade da reação é:
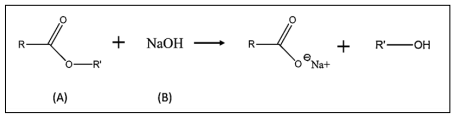
Considere que a reação simbolizada foi estudada no quesito cinético. Os dados empíricos das velocidades iniciais medidas para diferentes concentrações iniciais dos reagentes são mostrados no quadro:
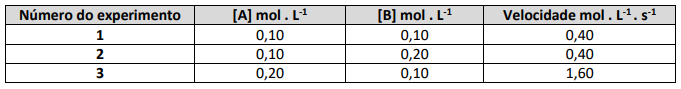
Com base nas informações fornecidas, a velocidade da reação (em mol . L-1 . s-1 ), quando [A] = 0,30 mol . L-1 e [B] for 0,10 mol . L-1 , será de:
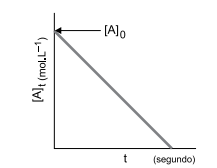
Os dados do estudo cinético de uma reação representada por
2 A → 2B + 3C
possibilitaram construção de uma curva de rapidez da reação, representada na figura a seguir.
(P. Atkins; L. Jones; Princípios de Química: questionando a vida
moderna e o meio ambiente. 5a
ed. Trad. Ricardo Bicca de Alencastro.
Porto Alegre: Bookman, 2012. Adaptado)
A ordem dessa reação e as unidades de sua constante
de velocidade são:
1. Há consumo de CYP3A4 no decorrer da reação.
2. A losartana e o CYP3A4 são reagentes da reação.
3. O CYP3A4 diminui a energia de ativação da reação.
4. O estado de equilíbrio da reação é alterado pelo CYP3A4 no sentido de formar mais derivado carboxilado.
Assinale a alternativa correta.
Considere a equação da reação hipotética: X + Y + Z → W + T + Q
São conhecidos os seguintes resultados do estudo cinético desta reação, obtidos nas mesmas condições experimentais:
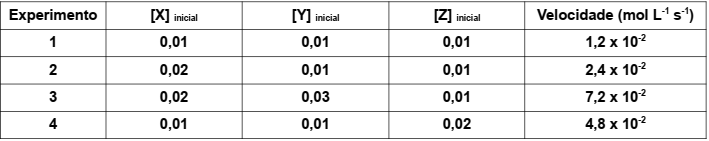
Considere [ ] = concentração mol L-1
.
A partir das observações experimentais, conclui-se que a equação da velocidade para a reação é
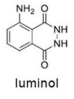
Tendo como referência a estrutura do luminol, apresentada anteriormente, e as informações do texto precedente, julgue o item a seguir, considerando que MH = 1 g/mol, MC = 12 g/mol, MN = 14 g/mol e MO = 16 g/mol.
O ferro presente na hemoglobina atua como catalisador na
reação do luminol com o sangue.
O gráfico que representa de forma adequada a relação entre a concentração da espécie A em solução com o decorrer da reação é:
Analise o diagrama.
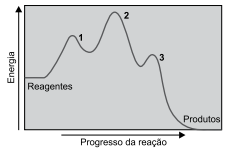
O diagrama representa uma reação _______________ , que ocorre em três etapas, sendo a mais ____________ a etapa 3, porque possui ____________ energia de ativação.
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
Uma certa espécie química A, quando em solução, reage rapidamente com oxigênio molecular dissolvido e é degradada por ele. A velocidade dessa reação segue a lei da velocidade v = k[A].
O gráfico que representa de forma adequada a relação entre a concentração da espécie A em solução com o decorrer da reação é:
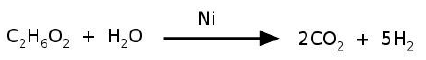
Nas condições mencionadas, a reação de reforma ocorre num tempo menor quando usado o níquel poroso porque:
αA + βΒ + χC D + E
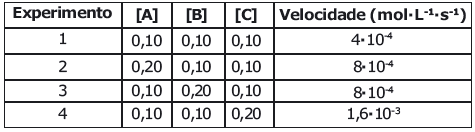
A partir dos resultados experimentais apresentados na tabela, pode se afirmar que a expressão da equação da lei da velocidade (V) para essa reação química é
A reação em fase gasosa a A + b B → c C + d D foi estudada em diferentes condições de concentração inicial dos reagentes, tendo sido obtidos os seguintes resultados experimentais, todos na mesma temperatura:
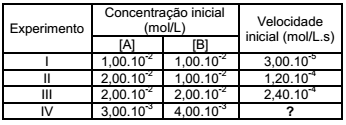
A partir dos dados experimentais da tabela, indique a
alternativa que apresenta o valor correto da velocidade
inicial da reação no experimento IV.
Conversores catalíticos (catalisadores) de automóveis são utilizados para reduzir a emissão de poluentes tóxicos. Poluentes de elevada toxicidade são convertidos a compostos menos tóxicos. Nesses conversores, os gases resultantes da combustão no motor e o ar passam por substâncias catalisadoras. Essas substâncias aceleram, por exemplo, a conversão de monóxido de carbono (CO) em dióxido de carbono (CO2) e a decomposição de óxidos de nitrogênio como o NO, N2O e o NO2 (denominados NOx) em gás nitrogênio (N2) e gás oxigênio (O2). Referente às substâncias citadas no texto e às características de catalisadores, são feitas as seguintes afirmativas:
I - a decomposição catalítica de óxidos de nitrogênio produzindo o gás oxigênio e o gás nitrogênio é classificada como uma reação de oxidorredução;
II - o CO2 é um óxido ácido que, ao reagir com água, forma o ácido carbônico;
III - catalisadores são substâncias que iniciam as reações químicas que seriam impossíveis sem eles, aumentando a velocidade e também a energia de ativação da reação;
IV - o CO é um óxido básico que, ao reagir com água, forma uma base;
V - a molécula do gás carbônico (CO2) apresenta geometria espacial angular.
Das afirmativas feitas estão corretas apenas a
Conversores catalíticos de automóveis são utilizados para reduzir a emissão de poluentes. Os gases resultantes da combustão no motor e o ar passam por substâncias catalisadoras que aceleram a transformação de monóxido de carbono (CO) em dióxido de carbono (CO2) e a decomposição de óxidos de nitrogênio (genericamente NxOy) em gás nitrogênio (N2) e gás oxigênio (O2). Em relação ao uso de catalisadores e as substâncias citadas no texto, são feitas as seguintes afirmações:
I – As reações de decomposição dos óxidos de nitrogênio a gás oxigênio e a gás nitrogênio ocorrem com variação no número de oxidação das espécies.
II – O CO2 é um óxido ácido que quando reage com a água forma o ácido carbônico.
III – Catalisadores são substâncias que iniciam as reações químicas que seriam impossíveis sem eles, aumentando a velocidade e também a energia de ativação da reação.
IV – O monóxido de carbono é um óxido básico que ao reagir com a água forma uma base.
V – A molécula do gás carbônico apresenta geometria espacial angular.
Das afirmativas feitas estão corretas apenas:
Um mineral muito famoso, pertencente ao grupo dos carbonatos, e que dá origem a uma pedra semipreciosa é a malaquita, cuja a fórmula é: Cu2(OH)2CO3 (ou CuCO3.Cu(OH)2).
Experimentalmente pode-se obter malaquita pela reação de precipitação que ocorre entre soluções aquosas de sulfato de cobre II e carbonato de sódio, formando um carbonato básico de cobre II hidratado, conforme a equação da reação:
2 CuSO4 (aq) + 2 Na2CO3 (aq) + H2O (l) → CuCO3.Cu(OH)2 (s) + 2 Na2SO4 (aq) + CO2 (g)
Na reação de síntese da malaquita, partindo-se de 1060 g de carbonato de sódio e considerando-se um rendimento de reação de 90%, o volume de CO2 (a 25 ºC e 1 atm) e a massa de malaquita obtida serão, respectivamente, de:
Dados: – massas atômicas Cu = 64 u; S = 32 u; O = 16 u; Na = 23 u; C = 12 u; H = 1 u.
– volume molar 24,5 L/mol, no estado padrão.
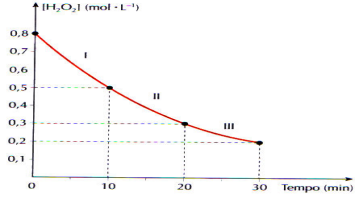 Calcule a velocidade média de decomposição da água
oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no
intervalo de 0 a 30 min:
Calcule a velocidade média de decomposição da água
oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no
intervalo de 0 a 30 min: A reação de hidrólise da acetilcolina, esquematizada abaixo, é fundamental na transmissão de impulsos nervosos nos seres vivos. A reação é promovida pela enzima acetilcolinesterase (AChE).
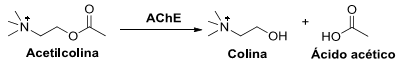
Considere as seguintes afirmativas sobre o papel de AChE nessa reação:
1. AChE é catalisador da reação.
2. AChE aumenta a energia de ativação da reação.
3. AChE promove caminhos reacionais alternativos.
4. AChE inibe a formação de intermediários.
Assinale a alternativa correta.