Questões de Concurso Militar ITA 2010 para Aluno - Química
Foram encontradas 18 questões
A 25 °C, três frascos (I, II e III) contêm, respectivamente, soluções aquosas 0,10 mol L−1 em acetato de sódio, em cloreto de sódio e em nitrito de sódio.
Assinale a opção que apresenta a ordem crescente CORRETA de valores de pHx (x = I,II e III) dessas soluções, sabendo que as constantes de dissociação (K) , a 25 °C, dos ácidos clorídrico (HCl) , nitroso (HNO2) e acético (CH3COOH) , apresentam a seguinte relação:
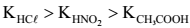
A 25 °C, as massas específicas do etanol e da água, ambos puros, são 0,8 g cm−3 e 1,0 g cm−3 , respectivamente. Adicionando 72 g de água pura a 928 g de etanol puro, obteve-se uma solução com 1208 cm3 de volume.
Assinale a opção que expressa a concentração desta solução em graus Gay-Lussac (°GL).
Considere a energia liberada em
I. combustão completa (estequiométrica) do octano e em
II. célula de combustível de hidrogênio e oxigênio.
Assinale a opção que apresenta a razão CORRETA entre a quantidade de energia liberada por átomo de hidrogênio na combustão do octano e na célula de combustível.
Dados: Energias de ligação, em KJ mol-1:
C – C 347 H – H 436
C – H 413 H – O 464
C = O 803 O = O 498
Em um experimento eletrolítico, uma corrente elétrica circula através de duas células durante 5 horas. Cada célula contém condutores eletrônicos de platina. A primeira célula contém solução aquosa de íons Au3+ enquanto que, na segunda célula, está presente uma solução aquosa de íons Cu2+ .
Sabendo que 9,85 g de ouro puro foram depositados na primeira célula, assinale a opção que corresponde à massa de cobre, em gramas, depositada na segunda célula eletrolítica.
Assinale a opção CORRETA que apresenta o potencial de equilíbrio do eletrodo A l3+ /A l ,em volt, na escala do eletrodo de referência de cobre-sulfato de cobre, à temperatura de 25 °C, calculado para uma concentração do íon alumínio de 10-3 mol-1 .
Dados: Potenciais de eletrodo padrão do cobre-sulfato de cobre
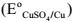 e do alumínio
e do alumínio 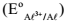 , na escala do
eletrodo de hidrogênio, nas condições-padrão:
, na escala do
eletrodo de hidrogênio, nas condições-padrão: 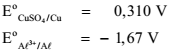
Em um experimento de laboratório, cloreto de alumínio, cloreto de zinco e carbonato de sódio são dissolvidos, individualmente, em três recipientes separados contendo água neutra aerada com pH = 7. Uma placa de ferro metálico é imersa em cada um dos recipientes, que são mantidos à temperatura de 25 °C.
Admitindo-se as condições experimentais apresentadas acima, são feitas as seguintes afirmações em relação à influência da hidrólise dos sais na velocidade de corrosão das placas metálicas:
I. O cátion alumínio hidratado forma soluções aquosas que aceleram a corrosão do ferro.
II. As soluções aquosas produzidas pela hidrólise do ânion carbonato inibem a corrosão do ferro.
III. A corrosão do ferro é inibida pela solução aquosa formada no processo de hidrólise do cátion zinco hidratado.
Das afirmações acima, está(ão) CORRETA(S) apenas
A reação catalisada do triacilglicerol com um álcool (metanol ou etanol) produz glicerol (1,2,3 propanotriol) e uma mistura de ésteres alquílicos de ácidos graxos de cadeia longa, mais conhecido como biodiesel. Essa reação de transesterificação envolve o equilíbrio representado pela seguinte equação química balanceada:
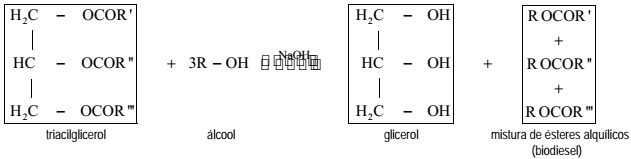
em que: R ', R ", R ''' = cadeias carbônicas dos ácidos graxos e R = grupo alquil do álcool reagente.
A respeito da produção do biodiesel pelo processo de transesterificação, são feitas as seguintes afirmações:
I. O hidróxido de sódio é dissolvido completamente e reage com o agente transesterificante para produzir água e o íon alcóxido.
II. Na transesterificação catalisada por álcali, os reagentes empregados nesse processo devem ser substancialmente anidros para prevenir a formação de sabões.
III. Na reação de produção do biodiesel pela rota etílica, com catalisador alcalino, o alcóxido formado inibe a reação de saponificação.
Das afirmações acima, está(ão) CORRETA(S) apenas
Considere as seguintes afirmações:
I. Um coloide é formado por uma fase dispersa e outra dispersante, ambas no estado gasoso.
II. As ligações químicas em cerâmicas podem ser do tipo covalente ou iônica.
III. Cristal líquido apresenta uma ou mais fases organizadas acima do ponto de fusão do sólido correspondente.
Então, das afirmações acima, está(ão) CORRETA(S)
Assinale a opção que apresenta a relação ERRADA a respeito do comprimento de ligação (R) entre
pares de moléculas (neutras, cátions ou ânions), todas no estado gasoso.
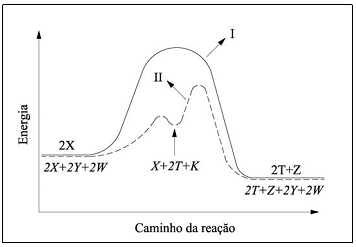
A figura mostra o perfil reacional da decomposição de um composto X por dois caminhos reacionais diferentes, I e II .
Baseado nas informações apresentadas nessa figura, assinale a opção ERRADA.
Considere dois cilindros idênticos (Cl e C2) , de paredes rígidas e indeformáveis, inicialmente evacuados. Os cilindros Cl e C2 são preenchidos, respectivamente, com O2(g) e Ne(g) até atingirem a pressão de 0,5 atm e temperatura de 50 ºC. Supondo comportamento ideal dos gases, são feitas as seguintes afirmações:
I. O cilindro C1 contém maior quantidade de matéria que o cilindro C2 .
II. A velocidade média das moléculas no cilindro C1 é maior que no cilindro C2 .
III. A densidade do gás no cilindro C1 é maior que a densidade do gás no cilindro C2 .
IV. A distribuição de velocidades das moléculas contidas no cilindro C1 é maior que a das contidas no cilindro C2 .
Assinale a opção que apresenta a(s) afirmação(ões) CORRETA(S).