Questões de Concurso Militar ITA 2011 para Aluno - Química
Foram encontradas 20 questões
Considere as seguintes afirmações:
I. Aldeídos podem ser oxidados a ácidos carboxílicos.
II. Alcanos reagem com haletos de hidrogênio.
III. Aminas formam sais quando reagem com ácidos.
IV. Alcenos reagem com álcoois para formar ésteres.
Das afirmações acima, está(ão) CORRETA(S) apenas
A reação de sulfonação do naftaleno ocorre por substituição eletrofílica nas posições α e β do composto orgânico, de acordo com o diagrama de coordenada de reação a 50 °C.
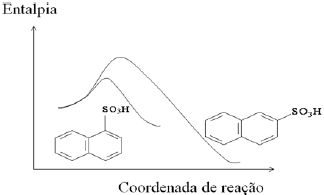
Com base neste diagrama, são feitas as seguintes afirmações:
I. A reação de sulfonação do naftaleno é endotérmica.
II. A posição α do naftaleno é mais reativa do que a de β.
III. O isômero β é mais estável que o isômero α.
Das afirmações acima, está(ão) CORRETA(S) apenas
Ag+ (aq) + e-
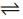 Ag(c); Eo = 0,799 e AgCl (c) + e-
Ag(c); Eo = 0,799 e AgCl (c) + e- 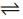 Ag(c) Cl- (aq); E = 0,222 V
Ag(c) Cl- (aq); E = 0,222 Vem que ο Eo é o potencial do eletrodo em relação ao eletrodo padrão de hidrogênio nas condições-padrão.
Considere as seguintes misturas (soluto/solvente) na concentração de 10 % em mol de soluto:
I. acetona/clorofórmio
II. água/etanol
III. água/metanol
IV. benzeno/tolueno
V. n-hexano/n-heptano
Assinale a opção que apresenta a(s) mistura(s) para a(s) qual(is) a pressão de vapor do solvente na mistura é
aproximadamente igual à sua pressão de vapor quando puro multiplicada pela sua respectiva fração molar.
Considere que a reação hipotética representada pela equação química X+Y → Z ocorra em três condições diferentes (a, b e c), na mesma temperatura, pressão e composição total (número de moléculas de X+Y), a saber:
a- O número de moléculas de X é igual ao número de moléculas de Y.
b- O número de moléculas de X é 1/3 do número de moléculas de Y.
c- O número de moléculas de Y é 1/3 do número de moléculas de X.
Baseando nestas informações, considere que sejam feitas as seguintes afirmações:
I. Se a lei de velocidade da reação for v = k [X].[Y]2, então vc < va < vb
II. Se a lei de velocidade da reação for v = k [X].[Y] , então vb = vc < va
III. Se a lei de velocidade da reação for v = k [X] , então t1/2(c) > t1/2(b) > t1/2(a)
Das afirmações acima, está(ão) CORRETA(S) apenas
Considere as seguintes afirmações a respeito dos haletos de hidrogênio HF HCl HBr e HI :
I. A temperatura de ebulição do HI é maior do que a dos demais. I
I. À exceção do HF ,os haletos de hidrogênio dissociam-se completamente em água.
III. Quando dissolvidos em ácido acético glacial puro, todos se comportam como ácidos, conforme a seguinte ordem de força ácida: HI > HBr > HCl >> HF
Das afirmações acima, está(ão) CORRETA(S) apenas
A 25 °C, a força eletromotriz da seguinte célula eletroquímica é de 0,45 V: Pt(s)|H2 (g, 1 atm) | H+ ( mol.L-1)|| KCl (0,1 mol.L -1) | Hg2 Cl2 (s) | Hg(l)| Pt (s) Sendo o potencial do eletrodo de calomelano – KCl (0,1 mol.L -1)| Hg2 Cl2 (s)| Hg(l)
– nas condições-padrão
igual a 0,28 V e x o valor numérico da concentração dos íons H+
, assinale a opção com o valor aproximado do
São feitas as seguintes afirmações a respeito dos produtos formados preferencialmente em eletrodos eletroquimicamente inertes durante a eletrólise de sais inorgânicos fundidos ou de soluções aquosas de sais inorgânicos:
I. Em CaCl2 (l) há formação de Ca s) no catodo.
II. Na solução aquosa 1×10-3mol.L −1 −em Na2SO4 há aumento do pH ao redor do anodo.
III. Na solução aquosa 1mol.L−1 em AgNO3 há formação de O2 (g) no anodo.
IV. Em NaBr (l) há formação de Br2 (l) no anodo.
Das afirmações acima, está(ão) ERRADA(S) apenas
São feitas as seguintes afirmações em relação à isomeria de compostos orgânicos:
I. O 2-cloro-butano apresenta dois isômeros óticos.
II. O n-butano apresenta isômeros conformacionais.
III. O metil-ciclo-propano e o ciclo-butano são isômeros estruturais.
IV. O alceno de fórmula molecular C4H8 apresenta um total de três isômeros.
V. O alcano de fórmula molecular C5H12 apresenta um total de dois isômeros.
Das afirmações acima, está(ão) CORRETA(S) apenas
I. C(s)+ 2H2(g) -> CH4 (g)
II. N2O(g) -> N2(g) + 1/2 O2 (g)
III. 2NI3 (s) -> N2 (g) + 3I2(g)
IV. 2O3(g) -> 3O2(g)
Assinale a opção que apresenta a(s) reação(ões) química(s) na(s) qual(is) há uma variação negativa de entropia.
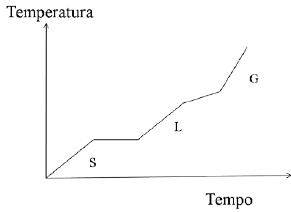
A figura representa a curva de aquecimento de uma amostra, em que S, L e G significam, respectivamente, sólido, líquido e gasoso. Com base nas informações da figura é CORRETO afirmar que a amostra consiste em uma
Considere os seguintes pares de moléculas:
I. LiCl KCl
II. AlCl3PCl3
III. NCl3AsCl3
Assinale a opção com as três moléculas que, cada uma no seu respectivo par, apresentam ligações com o maior
caráter covalente.
São descritos três experimentos (I, II e III) utilizando-se em cada um 30 mL de uma solução aquosa saturada, com corpo de fundo de cloreto de prata, em um béquer de 50 mL a 25 °C e 1 atm:
I. Adiciona-se certa quantidade de uma solução aquosa 1 mol.L−1 em cloreto de sódio.
II. Borbulha-se sulfeto de hidrogênio gasoso na solução por certo período de tempo.
III. Adiciona-se certa quantidade de uma solução aquosa 1 mol.L−1 em nitrato de prata.
Em relação aos resultados observados após atingir o equilíbrio, assinale a opção que apresenta o(s)
experimento(s) no(s) qual(is) houve aumento da quantidade de sólido.
Considere uma amostra aquosa em equilíbrio a 60 °C, com pH de 6,5, a respeito da qual são feitas as seguintes afirmações:
I. A amostra pode ser composta de água pura.
II. A concentração molar de H3O+ é igual à concentração de OH − .
III. O pH da amostra não varia com a temperatura.
IV. A constante de ionização da amostra depende da temperatura.
V. A amostra pode ser uma solução aquosa 0,1mol.L−1em H2 CO3, considerando que a constante de dissociação do H2 CO3 é da ordem de 1 x 10−7 .
Das afirmações acima está(ão) CORRETA(S) apenas