Questões de Concurso Militar ITA 2012 para Aluno - Química
Foram encontradas 19 questões
Uma alíquota de uma solução aquosa constituída de haletos de sódio foi adicionada a uma solução aquosa de nitrato de prata, com formação de um precipitado. À mistura contendo o precipitado, foi adicionada uma alíquota de solução aquosa diluída de hidróxido de amônio, com dissolução parcial do precipitado. Ao precipitado remanescente, foi adicionada uma alíquota de solução aquosa concentrada de hidróxido de amônio, verificando-se uma nova dissolução parcial do precipitado.
Sabendo que a mistura de haletos é constituída pelo fluoreto, brometo, cloreto e iodeto de sódio, assinale a alternativa CORRETA para o(s) haleto(s) de prata presente(s) no precipitado não dissolvido.
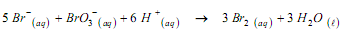
Sabendo que a velocidade de desaparecimento do íon bromato é igual a 5,63×10− 6 mol. L−1. s −1, assinale a alternativa que apresenta o valor CORRETO para a velocidade de aparecimento do bromo,Br2, expressa em mol . L−1.s −1⋅
Considere Y a quantidade (em mol) de iodo dissolvido em 100 mL de água, X um solvente praticamente imiscível em água e K (=120 ) a constante de partição do iodo entre o solvente X e a água a 25 0C. Assinale a alternativa CORRETA para o volume do solvente X necessário para extrair 90% do iodo contido inicialmente em 100 mL de água.
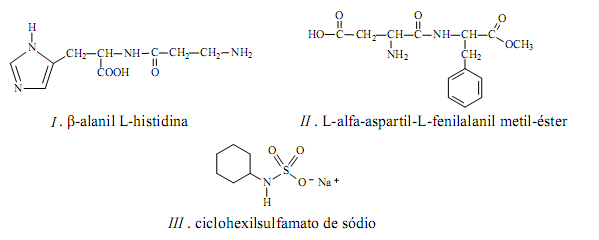
Considere as substâncias I , II e III representadas pelas seguintes fórmulas estruturais:
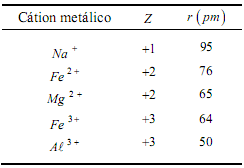
A tabela abaixo apresenta os números de cargas elétricas (Z) e o raio iônico (r) apresentados por alguns cátions metálicos.
Para as mesmas condições de temperatura e pressão é CORRETO afirmar que o pH de soluções aquosas, com concentração 1mol . L−1 dos nitratos de cada um dos cátions apresentados na tabela, aumenta na sequência:
Considere o produto de solubilidade (K ps), a 25 0C , das substâncias I II e III:
I. Cα (OH)2; K ps = 5,0 × 10 −6II. Mg (OH)2; K ps = 5,6 × 10 −12
III . Zn (OH)2; K ps = 3,0 × 10 −17
I. O átomo A deve ter maior energia de ionização que o átomo B.
II. A distância da ligação entre os átomos na molécula A2 deve ser menor do que aquela na molécula B2.
III. A energia de ionização do elétron no orbital 1s do átomo A deve ser maior do que aquela do elétron no orbital 1s do átomo de hidrogênio.IV. A energia de ligação dos átomos na molécula B2 deve ser menor do que aquela dos átomos na molécula de hidrogênio (H2) .
Das afirmações acima está(ão) CORRETA(S) apenas
Considere as seguintes substâncias:

