Questões de Concurso Militar ITA 2015 para Aluno - Química
Foram encontradas 20 questões
I. Para reações bimoleculares, o fator pré-exponencial na equação de Arrhenius é proporcional à frequência de colisões, efetivas ou não, entre as moléculas dos reagentes.
II. O fator exponencial na equação de Arrhenius é proporcional ao número de moléculas cuja energia cinética relativa é maior ou igual à energia de ativação da reação.
III. Multiplicando-se o negativo da constante dos gases (−R) pelo coeficiente angular da reta ln k versus 1/T obtém-se o valor da energia de ativação da reação.
IV. O fator pré-exponencial da equação de Arrhenius é determinado pela intersecção da reta ln k versus 1/T com o eixo das abscissas.
Das proposições acima, está(ão) ERRADA(S)
Considere os seguintes compostos químicos que se encontram no estado líquido à temperatura de 298 K e pressão ambiente de 1 bar:
I. 2-metil-pentano
II. 3-metil-pentano
III. 2,2-dimetil-butano
IV. 2,3-dimetil-butano
V. Hexano
Nestas condições, assinale a opção que apresenta a ordem decrescente da magnitude da pressão de vapor dos
respectivos compostos.
Considere a reação descrita pela seguinte equação química:
H2(g, 1bar) + 2AgBr(s) → 2H+ (aq) + 2Br−(aq) + 2Ag(s).
Sendo X o potencial padrão (E°) da reação, o pH da solução a 25 °C quando o potencial da reação (E) for Y
será dado por
No estado padrão, é de 0,240 V o potencial da pilha cuja reação pode ser descrita pela seguinte equação química:
2 NO + ½ O2 + H2O → 2 HNO2.
Assinale a alternativa que apresenta o valor da energia livre padrão da reação, em kJ·mol-1.
Considere uma célula eletrolítica na forma de um tubo em H, preenchido com solução aquosa de NaNO3 e tendo eletrodos inertes mergulhados em cada ramo vertical do tubo e conectados a uma fonte externa. Num determinado instante, injeta-se uma solução aquosa de CuCrO4 verde na parte central do ramo horizontal do tubo. Após algum tempo de eletrólise, observa azul e uma amarela, separadas (em escala) de acordo com o esquema da figura.
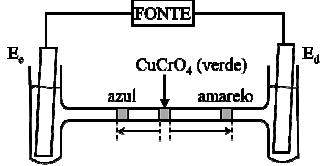
Com base nas informações do enunciado e da figura, assinale a opção ERRADA.
Considere as entalpias padrão de formação dos seguintes compostos:

Sabendo que a capacidade calorífica da água, à pressão constante, vale 75,9 J·mol-1 e que sua entalpia de vaporização é igual a 40,66 kJ·mol−1, assinale a alternativa que melhor corresponda ao número de mols de metano necessários para vaporizar 1 L de água pura, cuja temperatura inicial é 25°C, ao nível do mar.
Considere a expansão de um gás ideal inicialmente contido em um recipiente de 1 L sob pressão de 10 atm. O processo de expansão pode ser realizado de duas maneiras diferentes, ambas à temperatura constante:
I. Expansão em uma etapa, contra a pressão externa constante de 1 atm, levando o volume final do recipiente a 10 L.
II. Expansão em duas etapas: na primeira, o gás expande contra a pressão externa constante de 5 atm até atingir um volume de 2 L; na segunda etapa, o gás expande contra uma pressão constante de 1 atm atingindo o volume final de 10 L.
Com base nestas informações, assinale a proposição CORRETA.
2NO(g) + O2(g) →2NO2(g) , v = k[NO]2 [O2]
Para esta reação, são propostos os mecanismos reacionais I, II e III com suas etapas elementares de reação:
I. 2NO(g) ⇌ N2O2 (g) equilíbrio rápido
N2O2(g) + O2(g) → 2NO2 (g) lenta
II. NO(g) + O2 (g) ⇌ NO3(g) equilíbrio rápido
NO (g) + NO3 (g) → 2NO2 (g) lenta
III. NO(g) + ½ O2(g) → NO2(g) rápida
NO2(g) + ½ O2(g) ⇌ NO3(g) equilíbrio rápido
NO2(g) + NO3(g) ⇌ N2O4(g) equilíbrio rápido
N2O4(g) → 2NO2 (g) lenta
Dos mecanismos propostos, são consistentes com a lei de velocidade observada experimentalmente