Questões de Concurso Militar CIAAR 2017 para Primeiro Tenente - Engenharia Química
Foram encontradas 15 questões
Para que uma reação ocorra, é necessário que os reagentes recebam certa quantidade de energia, a chamada energia de ativação. As moléculas reagentes formarão o complexo ativado se tiverem energia suficiente e se colidirem de um modo geometricamente favorável para a formação do complexo.
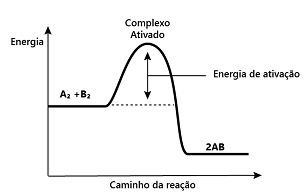
A respeito do complexo ativado, pode-se afirmar que
A hidrazina é um composto químico cuja fórmula química é N2H4 . Ela é usada, entre outras aplicações, como propelente para satélites artificiais, para produção de produtos químicos da agricultura e como removedor de oxigênio de caldeira. Usualmente, uma de suas principais reações conhecidas é a liberação dos gases quentes, quando em contato com um oxidante.
Considere a reação:
2N2H4(l) + N2O4(l) ↔ 3N2(g) + 4H2O(g) ΔH = -1094KJ
Interpretando a reação acima, o equilíbrio da reação desloca-se no sentido dos produtos
A soda cáustica é o nome comercial dado ao composto hidróxido de sódio (NaOH). Este composto é largamente aplicado na indústria para a purificação de derivados de petróleo e de óleos vegetais. É também utilizado na fabricação de produtos de uso doméstico, como o sabão.
Dado: MM (NaOH) = 40,00g/mol, qual a concentração em quantidade de matéria de uma solução que foi
preparada dissolvendo-se 200,00g de hidróxido de sódio em água e completando-se para 2,00L de solução?
É natural buscar a formação de classes ou grupos em função de interesses ou características comuns. Em se tratando de elementos químicos, a busca por agrupamentos com base em determinadas propriedades atômicas resultou no que se conhece hoje como a Tabela Periódica. Como consequência, tornou-se possível sistematizar, por exemplo, o conhecimento relativo às propriedades químicas e físicas dos elementos.
Sobre a propriedade do elemento Rádio (Ra) é correto afirmar que ele é o
O aciclovir é um antiviral utilizado no tratamento de infecções por herpes. Ele foi desenvolvido racionalmente pelos pesquisadores George Hitchings e Gertrude Elion, contemplados com Prêmio Nobel por essa descoberta. O aciclovir foi sintetizado a partir da guanina (A), gerando o composto (B). O Composto (C) reage gerando (D). O intermediário (B) reage com a cadeia lateral (D) na presença de ácido para-toluenosulfônico, para formar o derivado (E). O derivado reage à temperatura ambiente para fornecer o produto aciclovir (F).
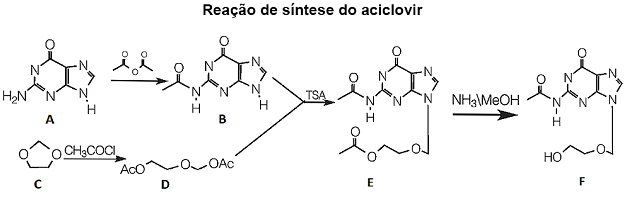
Disponível em: <http://qnesc.sbq.org.br/online/cadernos/03/sintese.pdf> )
Atorvastatina é um fármaco membro da classe de drogas conhecidas como estatinas, usadas para abaixar os níveis de colesterol no sangue. Ela também estabiliza a placa ateromatosa, evitando acidente vascular cerebral (AVC). A atorvastatina é uma das muitas estatinas no mercado.
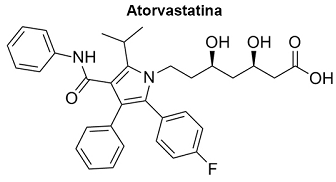
(Disponível em:<http://2.bp.blogspot.com/LLk_DC617Cs/Up4T8bKwt7I/AAAAAAAAAEg/nMKlfmh8SYM/s1600/512px-Atorvastatin.svg.png> )
Face ao exposto, o grupo funcional identificado na molécula de atorvastatina é
O polietileno (PE) é um dos plásticos mais importantes da atualidade, principalmente entre os termoplásticos, aqueles que se deformam com o calor. No caso do polietileno, a temperatura de deformação e fusão está entre 110ºC e 115°C. O polietileno pode existir em cinco diferentes variações, que são: PEAD (polietileno de alta densidade), PEBD (polietileno de baixa densidade), PELBD (polietileno linear de baixa densidade ou PEBDL), PEUAPM (polietileno de ultra-alto peso molecular) e PEUBD (polietileno de ultrabaixa densidade). Todos podem ser reciclados e comercializados como material recuperado. O polietileno, em suas variadas formas, possui propriedades únicas, tais como resistência ao impacto, alta flexibilidade, boa trabalhabilidade e estabilidade térmica e química (em determinadas condições).
Informe se é verdadeiro (V) ou falso (F) o que se afirma abaixo sobre o polietileno.
( ) Por meio da escolha de catalisadores apropriados e condições de reação, é possível controlar o tipo de polietileno gerado.
( ) O etileno não polimeriza sob condições suaves na ausência de um catalisador. As moléculas de etileno teriam de colidir a uma energia muito elevada para reagirem entre si.
( ) O polietileno pode ser obtido através de reações de polimerização por condensação.
A alternativa que apresenta a sequência correta é
A nitroglicerina é um líquido oleoso de cor amarelo-pálida. É altamente sensível ao choque. O simples ato de balançar o líquido pode causar a explosiva decomposição em gases de nitrogênio, dióxido de carbono, água e oxigênio. A equação química abaixo representa essa reação.
4C3H5N3O9 (l ) → 6N2 (g ) + 12CO2 (g ) + 10H2O (g ) + O2 (g )
Calcule o volume de gases CO2 produzido quando uma amostra de 200 gramas de nitroglicerina é detonada. Considere os seguintes dados: Massa g/mol: H = 1; C = 12; N = 14; O = 16; Constante universal dos gases: R = 8,2 · 10−2 atm · L · K−1 · mol−1; Pressão: 1 atm; Temperatura: 27°C e Volume Molar: 22,4 L . mol-1.
Mediante análise, marque a alternativa que apresenta corretamente o volume aproximado.
Inibidor de corrosão é uma substância ou mistura de substâncias que, quando presente em concentrações adequadas, no meio corrosivo, reduz ou elimina a corrosão. As seguintes afirmativas referem-se ao inibidor de corrosão.
I. Inibidores protetivos emulsionáveis em água deixam por evaporação uma película oleosa aplicada por diluição em água.
II. O método de proteção usando protetivos temporários é baseado na obtenção de uma película superficial, fácil de aplicar e remover.
III. Inibidores catódicos têm a capacidade de formar películas sobre as áreas anódicas e catódicas, interferindo com a ação eletroquímica.
IV. Inibidores anódicos atuam favorecendo as reações anódicas, protegendo o cátodo da corrosão. São eficazes, mesmos em pequenas concentrações.
Está correto apenas o que se afirma em
Corrosão é a destruição ou deterioração de um material devido à reação química ou eletroquímica com seu meio. A corrosão é a transformação de um material pela sua interação química ou eletroquímica com o meio.
Sobre os exemplos de métodos de combate à corrosão, é incorreto afirmar que
A Equação de Nernst, desenvolvida pelo químico e físico alemão Walther Hermann Nernst, é a relação quantitativa que permite calcular a força eletromotriz de uma pilha para concentrações de íons diferentes de uma unidade. Também é usada para cálculos em titulação de oxidação-redução.
A equação a 25°C pode ser escrita de forma reduzida como: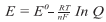
Sendo: R = 8,315 J K-1 mol-1; T = 298,2 K (25°C); F = 96485 C mol-1
Calcule a força eletromotriz para a seguinte pilha a 25°C: Fe / Fe2 + (0,02M) || Cu2
+(0,2M) / Cu
Dados: potencial padrão de redução (Eº Fe = -0,44V e Eº Cu = +0,40V).