Questões de Concurso Militar CIAAR 2018 para Primeiro Tenente - Engenharia Química
Foram encontradas 60 questões
Destilação é um processo de separação que se baseia na distribuição dos componentes de uma mistura em uma fase vapor e uma líquida. Os componentes serão separados segundo suas volatilidades. Nos destiladores, os componentes mais voláteis se direcionam para as regiões mais ao topo do equipamento, enquanto as menos voláteis vão para o fundo. O vapor que chega ao topo é condensado e parte é retirado como produto (destilado) e outra parte retorna para o destilador. O líquido que chega ao fundo se direciona para um ebulidor para que os componentes mais voláteis, que foram arrastados para o fundo, possam retornar para o equipamento na forma de vapor, enquanto parte é removida (resíduo).
Para aumentar a eficiência dos destiladores, é comum aquecer a alimentação utilizando calor proveniente do resíduo do processo.
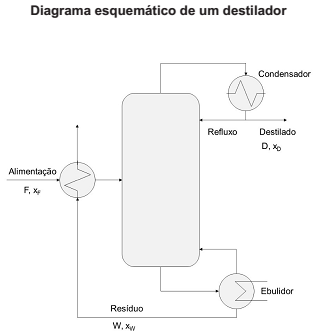
Fonte: Arquivo da Banca Elaboradora.
Considere uma operação em que são alimentados 200kg/h de uma mistura de A e B, que contém 40% em massa do componente A. Deseja-se que o destilado contenha 95%m/m de A e que somente 5% de A alimentado saia no resíduo.
As correntes de destilado e resíduo são, respectivamente:
O dono de uma empresa verificou que aumentaria muito seus lucros caso passasse a produzir uma de suas matérias-primas, ao invés de comprá-la, apesar do investimento inicial necessário. Essa matéria-prima é produzida a partir da decomposição de uma dada substância A. Ele desejava conseguir uma conversão de 85% utilizando até três reatores, com o menor volume total possível. Primeiramente, ele pediu a um de seus funcionários que estudasse como a velocidade da reação se correlacionava com a conversão do reagente A.
O funcionário apresentou a tabela a seguir, em que a variação do número de moles do reagente A (dNA/dt) está expressa em mol/s.

A partir desses dados, foi possível desenhar o gráfico a seguir
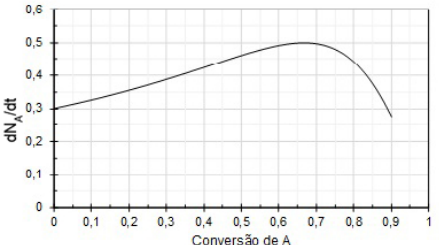
Fonte: Arquivo da Banca Elaboradora.
Assim, o dono da empresa verificou que, para atender suas condições, o ideal seria utilizar um
Catalisadores são substâncias que diminuem a energia de ativação de uma dada reação, sem alterar quais são os produtos formados ou a estequimetria da reação. Imagine que você esteja produzindo N2 e H2 a partir da decomposição da amônia.
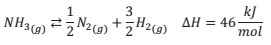
A energia de ativação para essa reação é igual a 150kJ/mol, em um meio homogêneo, na ausência de um catalisador, e cai para 87kJ/mol na presença de um catalisador sólido específico.
Considere as seguintes afirmações sobre a decomposição da amônia.
I. A velocidade da reação na superfície do catalisador depende da área superficial do catalisador.
II. As constantes de velocidade para os dois casos (sem e com catalisador) são iguais.
III. A velocidade no meio homogêneo é igual a da mesma reação no meio heterogêneo.
Está correto o que se afirma em:
As equações a seguir são as relações termodinâmicas fundamentais para 1 mol de um fluido homogêneo com composição constante.
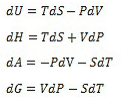
As propriedades termodinâmicas expressas nessas equações são: energia interna (U), entalpia (H), energia de Helmholtz (A), energia de Gibbs (G), temperatura (T), pressão (P), volume (V) e entropia (S).
A partir dessas relações fundamentais, é possível encontrar outras correlações que permitem realizar
experimentos simples para estudos bastante complexos. Por exemplo, caso queira verificar como a energia
de Gibbs varia com a entropia, mantendo-se a temperatura constante, pode-se utilizar os dados de um
experimento em que observa-se a variação da(o)
A seguir são apresentadas as entalpias de formação de alguns compostos. Analise-as
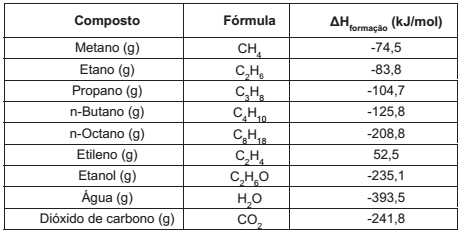
SMITH, J. M.; VAN NESS, H. C.; ABBOTT, M. M. Introdução à termodinâmica da Engenharia Química. 7 ed. Rio de Janeiro: LTC, 2007. p. 514-515.
A partir da análise desses dados, é correto afirmar que
Em um reator foram colocados 50mol de uma substância A e 50mol de uma substância B. Essas substâncias reagem segundo as equações.
A + B ⇄ C
A + C ⇄ D
Quando o sistema atinge o equilíbrio, as frações molares de A e B são 0,05 e 0,10, respectivamente. Já as
frações de C e D são:
Polímeros são macromoléculas constituídas pela repetição de uma pequena unidade molecular (mero) de um determinado composto químico. A reação que dá origem a um polímero é denominada reação de polimerização, em que a molécula inicial (monômero) se agrupa sucessivamente com outras, produzindo o dímero, trímero, tetrâmero e, por fim, o polímero.
Quando um polímero tem como matéria prima monômeros diferentes, ele é chamado de copolímero. Observe os pares de substância abaixo.
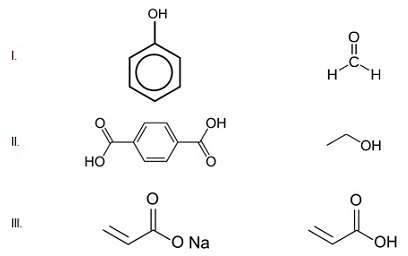
.Fonte: Arquivo da Banca Elaboradora
É possível formar copolímeros utilizando os pares
Um tubo cilíndrico fechado nas extremidades é dividido em dois compartimentos (A e B) por um pistão móvel. No compartimento A foi adicionado 1g de um gás ideal, que possui massa molar M, a 300K. No compartimento B foi adicionado 1g de um outro gás ideal, que possui massa molar 2M, a 900K.
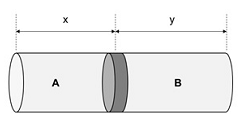
Fonte: Arquivo da Banca Elaboradora.
Quando o sistema entrar em equilíbrio mecânico, a razão entre os comprimentos y e x, será igual a
Diagramas ternários são diagramas utilizados para sistemas compostos por três substâncias. Os diagramas ternários podem ter o formato de um triângulo equilátero ou um triângulo retângulo. A figura abaixo é um diagrama triângulo retângulo para um sistema composto por ácido acético, água e éter isopropílico, a 20°C.
Nesse diagrama, as linhas sólidas representam a separação entre as regiões em que há somente uma fase ou duas fases em equilíbrio, e as linhas tracejadas representam as linhas de amarração.
Diagrama triângulo retângulo para o sistema ácido acético, água, éter isopropílico a 20°C
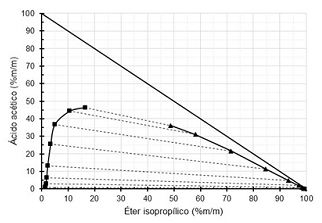
Fonte: Arquivo da Banca Elaboradora.
Um aluno observando esse diagrama fez algumas anotações.
I. Ácido acético é completamente solúvel em água.
II. Ácido acético e éter isopropílico são parcialmente solúveis entre si.
III. Água e éter isopropílico são parcialmente solúveis entre si.
IV. É impossível remover ácido acético de uma solução aquosa utilizando éter isopropílico.
V. Não é possível saber, pelo diagrama, a concentração de água em um determinado ponto.
É correto apenas o que o aluno afirmou em:
Vários processos estão disponíveis para o tratamento de água. As etapas de tratamento dependem, principalmente da fonte, da quantidade necessária a ser tratada e da qualidade necessária em seu uso, ou seja, a água utilizada na lavagem de minérios em indústrias metalúrgicas não necessita ter a mesma qualidade da exigida na fabricação de alimentos. Imagine um processo em que as etapas desinfecção, filtração, floculação e sedimentação apareçam.
A ordem, entre a captação da água e a distribuição para uso urbano, que essas etapas devem aparecer é:
O ácido sulfúrico pode ser produzido a partir de diversas fontes de enxofre. Uma dessas fontes é o mineral pirita (FeS2 ) que passa por um processo conhecido como ustulação. A ustulação consiste em aquecer o mineral sulfetado a altas temperaturas, na presença de oxigênio, o que leva à produção de dióxido de enxofre (SO2 ). O dióxido de enxofre é então oxidado a trióxido de enxofre (SO3 ), na presença de catalisador, o qual é absorvido em água para a produção de ácido sulfúrico.
O óxido metálico obtido segue para as rotas seguintes de tratamento. Para a pirita, a etapa de ustulação até a de produção de ácido sulfúrico pode ser representada pelas seguintes equações químicas.
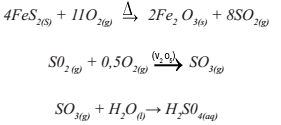
Dados: FeS2 = 120g/mol; Fe2 O3 = 160g/mol; O2 = 32g/mol; SO2 = 64g/mol; SO3 =80g/mol; H2O = 18g/mol; H2SO4 = 98g/mol
Dado que o mineral pirita é composto por 47% de ferro e 53% de enxofre, em massa, uma empresa que
produz 20.000 toneladas por mês de ácido sulfúrico, utilizando um material composto por 70% de pirita e 30%
de impurezas. Por mês, a quantidade, em toneladas, de pirita impura consumida pela empresa
Quando se deseja estudar a distribuição de tamanho de partículas, é necessário, inicialmente, medir os tamanhos das partículas. A técnica mais utilizada para isso é o peneiramento, que consiste no empilhamento de peneiras que possuem malhas de aberturas diferentes, sendo as de malhas mais largas colocadas no topo e as de malhas mais estreitas colocadas no fundo.
No estudo de distribuição do tamanho de partículas, não se caracteriza como uma dificuldade da técnica de peneiramento,
Um trocador de calor operando em contracorrente é alimentado por 10kg/s de água fria, a 15°C, e 5kg/s de água quente a 60°C.
Considerando que o calor específico da água se mantenha constante em 4,18kJ/kg°C, maior taxa de transferência de calor possível e, as temperaturas de saída dos fluidos quente e frio são:
Informe se é verdadeiro (V) ou falso (F) o que se afirma abaixo sobre métodos de prevenção da corrosão.
( ) O primeiro passo na prevenção da corrosão é selecionar com cuidado o material a ser utilizado, pois materiais mais resistentes aumentarão o custo de aplicação, caso outras alternativas de proteção não sejam possíveis.
( ) A alteração da natureza do ambiente de aplicação pode ser uma alternativa bastante viável.
( ) A passivação consiste em promover uma reação na superfície de um material, antes de sua aplicação, para que nas condições de aplicação ele seja inerte.
( ) A proteção catódica consiste na adição de sal ao ambiente em que a estrutura metálica será empregada, de forma a se ter um fornecimento de cátions para a corrosão.
Assinale a alternativa que apresenta a sequência correta.
Analise as afirmações a seguir.
I. A fratura frágil ocorre quando se é aplicado sobre um material uma força estática. Não são observadas deformações apreciáveis, mas uma rápida propagação da trinca.
II. A fadiga ocorre quando há uma aplicação de uma força dinâmica e oscilante sobre o material.
III. A fluência ocorre devido à operação em temperaturas elevadas e à aplicação de tensões mecânicas estáticas.
Pode-se concluir que
“Quando um eletrólito é adicionado à água, independentemente se a solubilidade é alta ou baixa, ocorre a sua dissociação (liberação de íons) ou ionização (produção de íons). Porém, ao mesmo tempo, esses íons voltam a formar o eletrólito, ocorrendo um equilíbrio químico de dissolução.”
(Produto de solubilidade - Manual da Química (manualdaquimica.uol.com.br). Acesso em: 15/02/2018).
Considere os carbonatos apresentados na tabela abaixo e seus respectivos valores da constante de produto de solubilidade (Kps) a 25°C.

A partir dos dados da tabela, foram feitas as seguintes afirmações sobre as solubilidades molares.
I. Carbonato de zinco é mais solúvel do que carbonato de cádmio.
II. Carbonato de zinco é mais solúvel do que carbonato de prata.
III. Carbonato de prata é mais solúvel do que carbonato de cádmio.
É verdadeiro o que se afirma em:
No estudo da precipitação de íons metálicos, existem vários diagramas que podem ser utilizados, como o de precipitação, o de especiação e o diagrama Eh-pH. Nesse último, para uma faixa de potenciais (Eh) e de pH, podem ser observados todas as espécies presentes, para uma temperatura e concentração do elemento de interesse.
A seguir pode-se observar o diagrama Eh-pH para o cádmio em solução aquosa.
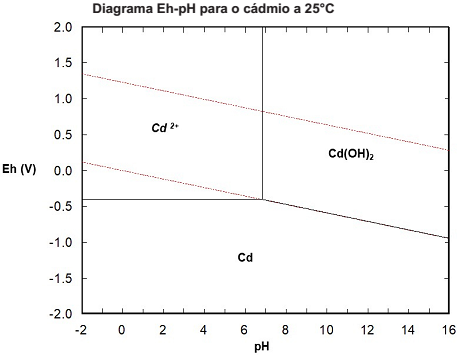
Fonte: Arquivo da Banca Elaboradora.
A partir desse diagrama, é correto afirmar que
A nitroglicerina é um líquido oleoso de coloração amarela, levemente esverdeada, da classe dos explosivos, substâncias que se decompõem rapidamente, com expansão súbita de gases e grande liberação de energia. Possui massa molecular de 227g.mol-1 e sua temperatura não deve ultrapassar 30°C, nem ser exposta a choques mecânicos. A nitroglicerina é obtida através da nitração da glicerina, utilizando ácido sulfúrico como catalisador. A reação da decomposição da nitroglicerina pode ser escrita como:
4C3 H5 N3 O9(l) → 10H2O(g) + 6N2(g) + O2(g) + 12CO2(g)
Sabendo que a constante dos gases é igual a 8,314J.mol-1.K-1, a decomposição de 227g de nitroglicerina a
27°C e 1,01kPa, vai liberar cerca de quantos litros de gases?
Uma das ferramentas que pode auxiliar nos estudos de obtenção de tampões ou até mesmo de precipitação, é o digrama de especiação. Nesse diagrama, podem ser observadas as espécies presentes no meio para diferentes valores de pH e suas concentrações (representadas como pC, que é o negativo do logaritmo das concentrações). A seguir, está apresentado o diagrama de especiação do ácido cianídrico, a 25°C para uma concentração total de cianeto igual a 10-3mol/L (pC=3). O ácido cianídrico é altamente tóxico, no entanto é largamente utilizado no tratamento de ouro.
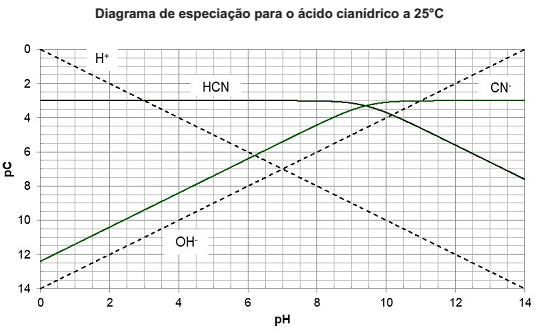
A partir do diagrama, considerando que uma solução com concentração de 10-3mol/L de ácido cianídrico seja
ideal, a 25°C, em um recipiente fechado, o pH da solução será igual a