Questões de Concurso Militar CBM-PA 2016 para Aspirante do Corpo de Bombeiro
Foram encontradas 10 questões
H+ (aq) + HCO– 3(aq)↔ H2CO3(aq) ↔ H2O(l) + CO2(g)
A regulagem do pH do plasma sanguíneo relaciona‐se diretamente ao transporte efetivo de O2 para os tecidos corpóreos. O oxigênio é carregado pela proteína hemoglobina encontrada nas células de glóbulos vermelhos. A hemoglobina (Hb) liga‐se reversivelmente tanto ao H+ quanto ao O2.
HbH+ + O2↔ HbO2 + H+
De acordo com as reações apresentadas, marque V para as afirmativas verdadeiras e F para as falsas.
( ) Durante períodos de esforço vigoroso grandes quantidades de CO2 são produzidas pelo metabolismo, que desloca o equilíbrio para a direita, diminuindo o pH.
( ) Quando o sangue atinge os tecidos nos quais a concentração de O2 é baixa, o equilíbrio desloca‐se para a esquerda e O2 é liberado.
( ) Durante períodos de esforço vigoroso, à medida que O2 é consumido, o equilíbrio desloca‐se para a direita de acordo com o princípio de Le châtelier.
( ) A remoção de CO2 por exalação desloca o equilíbrio para a direita, consumindo íons H+ .
A sequência está correta em
(Dados: log 1,49 = 0,17 e log 1,18 = 0,07.)
I. As partículas em um gás interagem entre si apenas quando as colisões ocorrem.
II. A energia cinética média das partículas em um gás é proporcional à temperatura absoluta do gás e depende da identidade do gás.
III. As partículas em um gás movem‐se em linhas retas, exceto quando elas colidem com outras moléculas ou com as paredes do recipiente. As colisões entre si e com as paredes do recipiente são elásticas, de tal forma que a energia cinética das partículas é conservada.
Está(ão) correta(s) a(s) afirmativa(s)
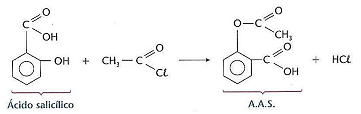
De acordo com o exposto, analise as afirmativas a seguir.
I. Na reação apresentada anteriormente o nome oficial do haleto de acila e do ácido salicílico é cloreto de etanoíla e ácido 2‐hidróxi‐benzóico.
II. Uma solução de 0,015 mol/L de aspirina com pH = 3 possui uma constante de dissociação ácida igual a 1,3 x 10–3.
III.A porcentagem de ácido ionizada na solução de 0,20 mol/L de aspirina com pH = 5 é 1,7%.
Está(ão) correta(s) a(s) afirmativa(s)
I. CH3‐CH2‐CH3 + Cl2 → CH3‐CH2‐CH2‐Cl + HCl é uma reação de substituição.
II. 2 CH3‐CH2‐OH
 H2O+ CH3‐CH2‐O‐CH2‐CH3 é uma reação de adição.
H2O+ CH3‐CH2‐O‐CH2‐CH3 é uma reação de adição.III. CH2=CH2 + Br2 → CH2Br‐ CH2Br é uma reação de adição.
Está(ão) correta(s) a(s) afirmativa(s)
( ) O nome 1,2‐dimetilciclopropano designa um conjunto de isômeros, os quais apresentam isomeria geométrica e óptica.
( ) No ácido láctico (ácido 2‐hidróxi‐propanóico), o carbono de número 2 é assimétrico e o composto apresenta isomeria óptica.
( ) O composto 1,2‐dicloroeteno não apresenta isomeria geométrica ou cis‐trans.
( ) O 3‐metil‐1‐propanol é isômero do 1‐butanol.
A sequência está correta em
Fe2+(aq) + 2e– → Fe(s) E0 red = –0,44V.
Zn2+(aq) + 2e– → Zn(s) E0 red = –0,76V.
O2(g) + 4H+ (aq) + 4e– → 2H2O(l) E0 red = 1,23V.
Acerca do exposto anteriormente, analise as afirmativas a seguir.
I. A redução de O2 necessita de H+ , de forma que o aumento da concentração de H+ torna‐se a redução de O2 menos favorável.
II. O Fe2+ formado no anodo é eventualmente mais oxidado a Fe+3, que forma o óxido de ferro III hidratado.
III.O Fe2+ é mais facilmente reduzido que Zn2+.
Está(ão) correta(s) a(s) afirmativa(s)
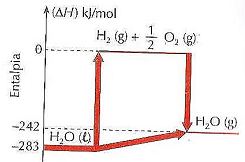
A partir do diagrama de entalpia, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A quantidade de calor envolvido na decomposição de 126 g de H2O(l) → H2(g) + ½ O2(g) é 1.981 kJ/mol.
( ) H2O(l) → H2O(g) ΔH = –41 kJ/mol.
( ) H2(g) + ½ O2(g)→ H2O(g) ΔH = +242 kJ/mol.
A sequência está correta em
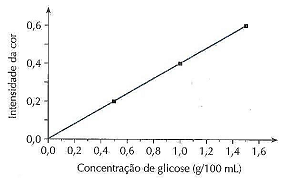
“Uma amostra de urina, submetida ao tratamento anterior, apresentou uma intensidade de cor igual a 0,4 na escala do gráfico." Qual a concentração em mols desta amostra?
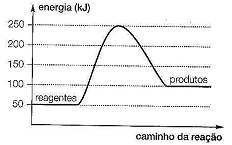
Considerando o gráfico anterior, referente ao diagrama energético de uma reação química, qual o valor da energia de ativação e o ΔH da reação respectivamente?