Questões de Concurso Militar EsFCEx 2010 para Oficial - Magistério Química
Foram encontradas 39 questões
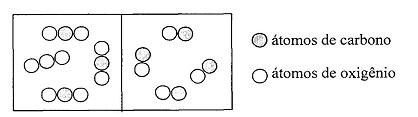
( ) O compartimento da esquerda contém mais elementos que o da direita.
( ) Os compartimentos contêm a mesma massa de carbono.
( ) A proporção de oxigênio para carbono é a mesma em ambos os compartimentos.
( ) As quantidades de matéria de cada gás são as mesmas em cada compartimento.
I. Obtenção do alumínio a partir da bauxita (Al2O3).
II. Obtenção de aluminio a partir da reciclagem de latinhas.
III. Obtenção de sacos plásticos a partir do eteno.
IV. Obtenção de pregos a partir de material enferrujado.
Dos processos citados, quais são os que representam reações químicas.
I. À distância de 0,074 nm a energia cinética é máxima.
II. Quando a distância entre esses dois átomos é 0,074 nm a energia potencial é mínima.
III. A energia necessária para romper um mol de ligações de H2 é 458 kJ.
IV. A distância de 0,074 nm é o comprimento da ligação no H2
O esquema a seguir representa de um modo geral, o diagrama de energia para os orbitais moleculares de moléculas diatômicas formadas por elementos do 2° período da tabela periódica.
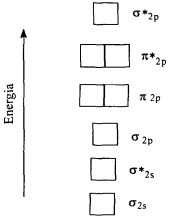
Ao usá-lo para fazer as configurações eletrônicas das espécies químicas N2, O2,
0 2+, F2, e CO, pode-se afirmar que:
PF5. SF4, SF6, SO42-, NO2, HCN, BF4-
Com relação a essas espécies pode-se afirmar que:
I. A molécula I2 é mais polarizável que Cl2
II. O momento de dipolo de HI é maior que o de HCl.
III. O cátion Na+ é mais polarizante que Li+
IV. O caráter covalente no cloreto de lítio é maior que no cloreto de sódio.
V. As forças intermoleculares entre Cl2 são mais intensas que entre I2-
I. A fusão do enxofre elementar,S8(s) produz moléculas S8
II. Sílica, (SiO2)n é um exemplo de sólido molecular.
III. A fusão da sílica, (SiO2)n, ocorre com quebra das ligações Si-O.
IV. Sólidos iônicos são bons condutores de eletricidade.
V. As partículas formadoras dos sólidos metálicos são átomos.
I. Ambas as etapas 1 e 2 ocorrem com absorção de calor.
II. Se a energia da etapa 3 suplantar a soma de 1 e 2, o processo é exotérmico.
III. A etapa 3 pode ser exotérmica ou endotérmica a depender do soluto.
IV. Se a soma de 1 e 2 for maior que o módulo de 3, a dissolução libera calor.
V. Se a energia para separar as partículas do soluto for elevada, não ocorrerá a dissolução.
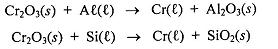
Após balancear as equações acima, assinale a alternativa correta.
I. Segundo o princípio de Le Châtelier a adição de H+ ao sistema tampão faz liberar mesma quantidade de OH-.
II. O sistema tampão funciona no sistema digestivo, mas não no sistema sanguíneo.
III. Por adição do sal à solução do ácido para formar o tampão, a percentagem de dissociação do ácido diminui.
IV. A solução tampão sofre pequena variação de pH quando a ela são adicionados íons H+ ou OH-.