Questões de Concurso Militar EsPCEx 2010 para Cadete do Exército, 1° Dia
Foram encontradas 12 questões
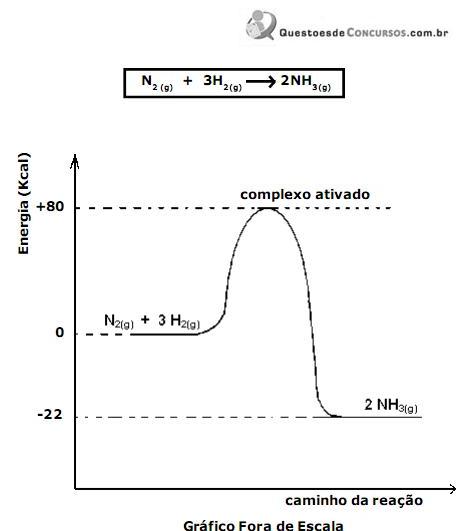
Relativo ao gráfico envolvendo essa reação e suas informações, são feitas as seguintes afirmações:
I - O valor da energia envolvida por um mol de NH3 formado é 22 kcal.
II - O valor da energia de ativação dessa reação é 80 kcal.
III - O processo que envolve a reação N2(g) + 3H2(g) → 2NH3(g) é endotérmico.
Das afirmações feitas, está(ão) correta(s)

Admita a variação de concentração em mol por litro (mol·L-1) do monóxido de nitrogênio (NO) em função do tempo em segundos (s), conforme os dados, da tabela abaixo:
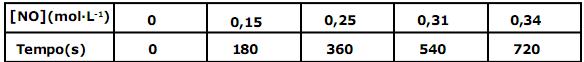
A velocidade média, em função do monóxido de nitrogênio (NO), e a velocidade média da reação acima representada, no intervalo de tempo de 6 a 9 minutos (min), são, respectivamente, em mol·L-1·min-1:
Etapa I S8(s) + O2(g) → SO2(g)
Etapa II SO2(g) + O2(g) → SO3(g)
Etapa III SO2(3) + H2O(l) → H2SO4(aq)
Considerando as etapas citadas e admitindo que o rendimento de cada etapa da obtenção do ácido sulfúrico por esse método é de 100%, então a massa de enxofre ( S8(s) ) necessária para produzir 49 g de ácido sulfúrico ( H2SO4(aq) ) é:

I - A configuração eletrônica, segundo o diagrama de Linus Pauling, do ânion trivalente de nitrogênio ( 7N3- ), que se origina do átomo nitrogênio, é 1s2 2 s2 2p6.
II - Num mesmo átomo, não existem dois elétrons com os quatro números quânticos iguais.
III - O íon
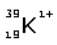 possui 19 nêutrons.
possui 19 nêutrons.IV - Os íons Fe2+ e Fe3+ do elemento químico ferro diferem somente quanto ao número de prótons.
Das afirmações feitas, está(ão) correta(s)
I - O número atômico do ferro (Fe) é 26.
II - O nível/subnível 3d6 contém os elétrons mais energéticos do átomo de ferro (Fe), no estado fundamental.
III - O átomo de ferro (Fe), no nível/subnível 3d6, possui 3 elétrons desemparelhados, no estado fundamental.
IV - O átomo de ferro (Fe) possui 2 elétrons de valência no nível 4 (4s2), no estado fundamental.
Das afirmações feitas, está(ão) correta(s)
Observação:
Adote a convenção de que o primeiro elétron a ocupar um orbital possui o número quântico de spin igual a -1/2.
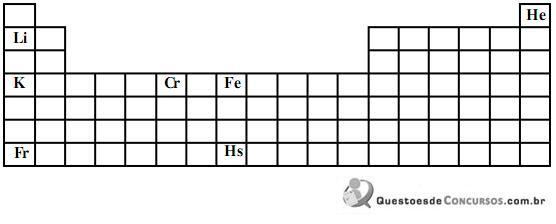
Sobre tais elementos químicos, assinale a alternativa correta.
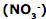 , a molécula de amônia
, a molécula de amônia  , a molécula de dióxido de enxofre
, a molécula de dióxido de enxofre 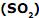 e a molécula de ácido bromídrico (HBr) apresentam, respectivamente, a seguinte geometria:
e a molécula de ácido bromídrico (HBr) apresentam, respectivamente, a seguinte geometria:
I - No modelo de Dalton, o átomo é dividido em prótons e elétrons.
II - No modelo de Rutherford, os átomos são constituídos por um núcleo muito pequeno e denso e carregado positivamente. Ao redor do núcleo estão distribuídos os elétrons, como plane- tas em torno do Sol.
III - O físico inglês Thomson afirma, em seu modelo atômico, que um elétron, ao passar de uma órbita para outra, absorve ou emite um quantum (fóton) de energia.
Das afirmações feitas, está(ão) correta(s)
Dados
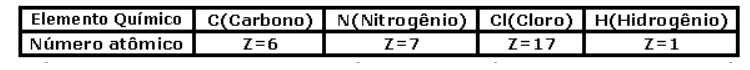

As fórmulas químicas das substâncias citadas nesse quadro são, na ordem, respectivamente:
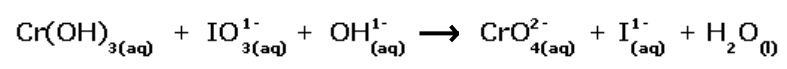
Considerando o método de balanceamento de equações químicas por oxi-redução, a soma total dos coeficientes mínimos e inteiros das espécies envolvidas, após o balanceamento da equação iônica, e o agente oxidante são, respectivamente,