Questões de Concurso Militar EsPCEx 2011 para Cadete do Exército - 3° Dia
Foram encontradas 20 questões
(25 °C e 1 atm), expressas em kJ · mol -1.

A alternativa que corresponde ao valor da entalpia da reação abaixo, nas condições-padrão, é:
4 C(grafita)(s) + 5 H2(g) → C4H10(g)
Dada a seguinte equação iônica de oxidorredução:
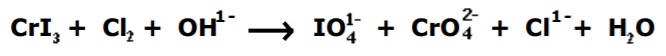
Considerando o balanceamento de equações químicas por oxidorredução, a soma total dos coeficientes mínimos e inteiros obtidos das espécies envolvidas e o(s) elemento(s) que sofrem oxidação, são, respectivamente,
FeSO4(aq) + Ag(s) → não ocorre a reação
2 AgNO3(aq) + Fe(s) → Fe(NO3)2(aq) + 2 Ag(s)
3 Fe(SO4)(aq) + 2 Al(s) → Al2(SO4)3(aq) + 3 Fe(s)
Al2(SO4)3(aq) + Fe (s) → não ocorre a reação
De acordo com as reações acima equacionadas, a ordem decrescente de reatividade dos metais envolvidos em questão é:
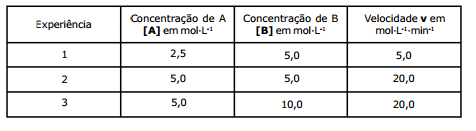
Baseando-se na tabela, são feitas as seguintes afirmações:
I- A reação é elementar.
II- A expressão da velocidade da reação é v=K·[A] 3·[B]2.
III- A expressão da velocidade da reação é v=K·[A] 2.[B]0.
IV- Dobrando-se a concentração de B, o valor da velocidade da reação não se altera.
V- A ordem da reação em relação a B é 1 (1ª ordem).
Das afirmações feitas, utilizando os dados acima, estão corretas apenas
4 C3H5(NO3)3(l) → 6 N2(g) + 12 CO(g) + 10 H2O(g) + 7 O2(g)
Considerando os gases acima como ideais, a temperatura de 300 Kelvin (K) e a pressão de 1 atm, o volume gasoso total que será produzido na detonação completa de 454 g de C3H5(NO3)3(l) é:
Dados:
Elemento H(hidrogênio) C( carbono) O ( Oxigênio) N( nitrogênio)
Massa 1 12 16 14
atômica(u)
Constante universal dos gases: R=8,2 · 10-2 atm · L · K-1 · mol-1
A Tabela II mostra os elementos químicos (H, F, Cl, Br e I) e suas respectivas massas atômicas.
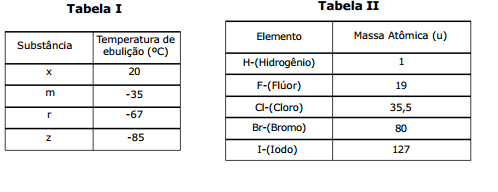
Com base nas Tabelas acima, são feitas as seguintes afirmações:
I- As substâncias correspondentes a x, m, r e z são, respectivamente, HF, HI, HBr e HCl.
II- As moléculas de HCl, HBr e HI são unidas por forças do tipo pontes ou ligações de hidrogênio.
III- Das substâncias em questão, o HI apresenta a maior temperatura de ebulição, tendo em vista possuir a maior massa molar.
Das afirmações feitas, está(ão) correta(s) apenas:
A concentração em mol · L-1 dos íons sulfato ( SO
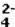 ) presentes na solução final é :
) presentes na solução final é :
Um laboratorista pesou separadamente uma amostra I, de hidróxido de sódio (NaOH), e uma amostra II, de óxido de cálcio (CaO), e, como não dispunha de etiquetas, anotou somente a soma das massas das amostras (I + II) igual a 11,2 g.
Cada uma das amostras I e II foi tratada separadamente com ácido sulfúrico (H 2SO4) produzindo, respectivamente, sulfato de sódio (Na2SO4) mais água (H2O) e sulfato de cálcio (CaSO4) mais água (H2O). Considere o rendimento das reações em questão igual a 100%.
Sendo a soma das massas dos sais produzidos (Na 2SO4 + CaSO4) igual a 25,37 g, então a massa da amostra I de hidróxido de sódio (NaOH) e a massa de amostra II de óxido de cálcio (CaO) são, respectivamente:
Dados:

I- 1s2 2s2 2p6
II- 1s2 2s2 2p6 3s1
III- 1s2 2s2 2p6 3s2
IV- 1s2 2s2 2p6 3s2 3p5
Com base nessas informações, a alternativa correta é:
A tabela abaixo apresenta alguns dos produtos químicos existentes em uma residência.
Assinale a alternativa correta:
I-mono-hidrogenossulfito de potássio + ácido clorídrico → ácido sulfuroso + cloreto de potássio
II-fosfato de cálcio + dióxido de silício + carvão → metassilicato de cálcio + monóxido de carbono + fósforo branco
A composição química do cimento Portland, utilizado na construção civil, varia ligeiramente conforme o que está indicado na tabela abaixo:
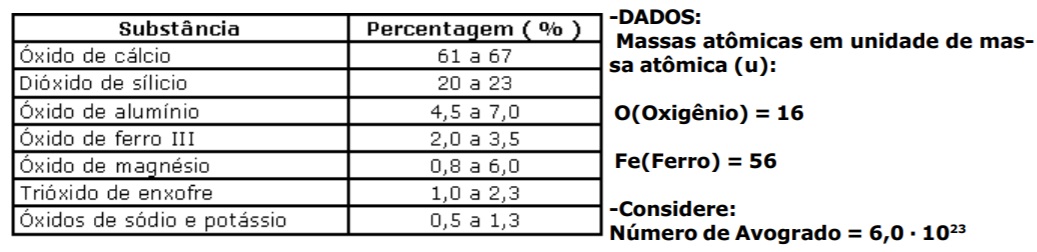
Assinale a alternativa correta:
Um antiácido estomacal contém bicarbonato de sódio (NaHCO3) que neutraliza o excesso de ácido clorídrico (HCl), no suco gástrico, aliviando os sintomas da azia, segundo a equação:
HCl(aq) + NaHCO3(aq) → NaCl(aq) + H2O(l) + CO2(g)
Sobre essas substâncias, são feitas as seguintes afirmações:
I-A fórmula estrutural do bicarbonato de sódio e do ácido clorídrico são respectivamente:
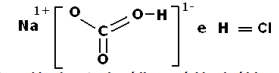
II-Na reação entre o bicarbonato de sódio e o ácido clorídrico, ocorre uma reação de oxidorredução.
III-O antiácido contém 4,200 g de bicarbonato de sódio para neutralização total de 1,825 g do ácido clorídrico presente no suco gástrico.
Dados:
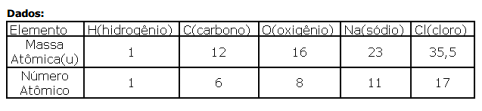
Das afirmações feitas, está(ão) correta(s)
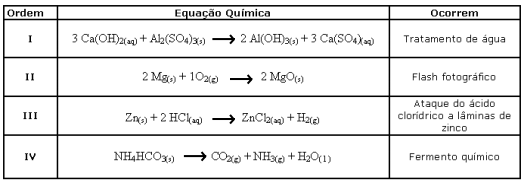
As equações químicas I, II, III e IV correspondem, nessa ordem, aos seguintes tipos de reação:
DADOS:
Potenciais padrão de redução (Eº red) a 1 atm e 25 ºC.
Al3+ + 3 e- Al Eº= - 1,66 V
Fe2+ + 2 e- Fe Eº= - 0,44 V
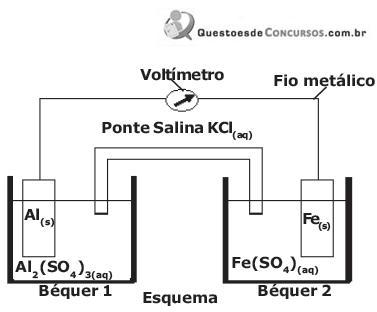
Considerando esta pilha e os dados abaixo, indique a afirmativa correta.
Abaixo está representada a sua fórmula estrutural.
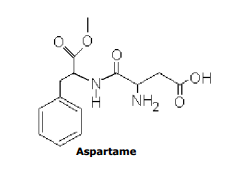
Sobre essa estrutura, são feitas as seguintes afirmações:
I- As funções orgânicas existentes na molécula dessa substância são características, apenas, de éter, amina, amida, ácido carboxílico e aldeído.
II- A fórmula molecular do aspartame é C13H15N2O5.
III- A função amina presente na molécula do aspartame é classificada como primária, porque só tem um hidrogênio substituido.
IV- A molécula de aspartame possui 7 carbonos com hibridização sp3 e 4 carbonos com hibridização sp2.
V- O aspartame possui 6 ligações π(pi) na sua estrutura.
Das afirmações feitas está(ão) corretas:
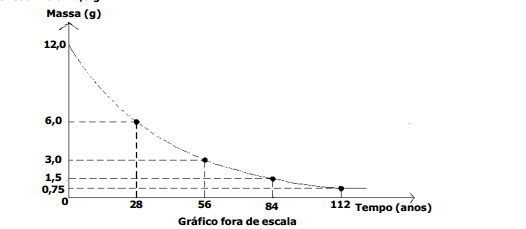
Em uma eletrólise ígnea do cloreto de sódio, uma corrente elétrica, de intensidade igual a 5 ampères, atravessa uma cuba eletrolítica, com o auxilio de dois eletrodos inertes, durante 1930 segundos.
O volume do gás cloro, em litros, medido nas CNTP, e a massa de sódio, em gramas, obtidos nessa eletrólise, são, respectivamente:
Em uma tabela, são dados 4(quatro) compostos orgânicos, representados pelos algarismos 1,2,3 e 4, e seus respectivos pontos de ebulição, à pressão de 1 atm. Esses compostos são propan-1-ol, ácido etanóico, butano e metoxietano, não necessariamente nessa ordem.
Sobre os compostos e a tabela acima são feitas as seguintes afirmações:
I- Os compostos 1, 2, 3 e 4 são respectivamente butano, metoxietano, propan-1-ol e ácido etanóico.
II- As moléculas do propan-1-ol, por apresentarem o grupo carboxila em sua estrutura, possuem interações moleculares mais fortes do que as moléculas do ácido etanóico.
III- O composto orgânico propan-1-ol é um álcool insolúvel em água, pois suas moléculas fazem ligações predominantemente do tipo dipolo induzido-dipolo induzido.
IV- O composto butano tem o menor ponto de ebulição, pois suas moléculas se unem por forças do tipo dipolo induzido-dipolo induzido, que são pouco intensas.
V- O composto metoxietano é um éster que apresenta em sua estrutura um átomo de oxigênio.
Das afirmações feitas está(ão) corretas:
Dados: Kw = 10-14 (mol · L-1)2