Questões de Concurso Militar EsPCEx 2012 para Cadete do Exército - 1° Dia
Foram encontradas 12 questões
Dada a seguinte equação iônica de oxidorredução da reação, usualmente utilizada em etapas de sínteses químicas, envolvendo o íon dicromato (Cr2O72-) e o ácido oxálico (H2C2O4):
Cr2O72- + H2C2O4 + H+→ + Cr3+ + CO2 + H2O
Considerando a equação acima e o balanceamento de equações químicas por oxidorredução,
a soma total dos coeficientes mínimos e inteiros obtidos das espécies envolvidas e a substância
que atua como agente redutor são, respectivamente,
DADOS:
Constante de Faraday= 96500 Coulombs/mol de elétrons
Massa molar do níquel=59 g/mol
Massa molar da prata=108 g/mol

Esse conjunto de cubas em série é ligado a uma bateria
durante um certo intervalo de tempo, sendo observado
um incremento de 54 g de massa de prata em um dos
eletrodos de prata. Desse modo, o incremento da massa
de níquel em um dos eletrodos de níquel é de

II – a reação Zn2+(aq) + Cu º(s) ➞ Zn º(s) + Cu2+(aq) não é espontânea;
III – pode-se estocar, por tempo indeterminado, uma solução de nitrato de níquel II, em um recipiente revestido de zinco, sem danificá-lo, pois não haverá reação entre a solução estocada e o revestimento de zinco do recipiente;
IV – a força eletromotriz de uma pilha eletroquímica formada por chumbo e magnésio é 2,24 V;
V – uma pilha eletroquímica montada com eletrodos de cobre e prata possui a equação global: 2 Ag+ (aq) + Cuº(s) ➞ 2 Agº(s) + Cu2+ (aq) .

A respeito dessa reação, são feitas as seguintes afirmações:
I – a reação direta trata-se de um processo exotérmico;
II – o denominador da expressão da constante de equilíbrio em termos de concentração molar (Kc) é igual a [H2O]·[C];
III – se for adicionado mais monóxido de carbono (CO(g)) ao meio reacional, o equilíbrio será deslocado para a esquerda, no sentido dos reagentes;
IV – o aumento na pressão total sobre esse sistema não provoca deslocamento de equilíbrio.
Das afirmações feitas, utilizando os dados acima, está(ão) correta(s):

Um isótopo radioativo de Urânio-238 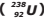 , de número atômico 92 e número de massa 238,
emite uma partícula alfa, transformando-se num átomo X, o qual emite uma partícula beta, produzindo
um átomo Z, que por sua vez emite uma partícula beta, transformando-se num átomo M. Um
estudante analisando essas situações faz as seguintes observações:
, de número atômico 92 e número de massa 238,
emite uma partícula alfa, transformando-se num átomo X, o qual emite uma partícula beta, produzindo
um átomo Z, que por sua vez emite uma partícula beta, transformando-se num átomo M. Um
estudante analisando essas situações faz as seguintes observações:
I – os átomos X e Z são isóbaros;
II – o átomo M é isótopo do Urânio-238 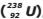
III – o átomo Z possui 143 nêutrons;
IV – o átomo X possui 90 prótons.
Das observações feitas, utilizando os dados acima, estão corretas:
Assinale a alternativa correta:
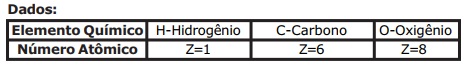
O etino, também conhecido como acetileno, é um alcino muito importante na Química. Esse composto possui várias aplicações, dentre elas o uso como gás de maçarico oxiacetilênico, cuja chama azul atinge temperaturas em torno de 3000 °C.
A produção industrial do gás etino está representada, abaixo, em três etapas, conforme as equações balanceadas:

Considerando as etapas citadas e admitindo que o rendimento de cada etapa da obtenção do
gás etino por esse método é de 100 %, então a massa de carbonato de cálcio (CaCO3(s)) necessária para produzir 5,2 g do gás etino (C2H2(g)) é
Uma amostra de 5 g de hidróxido de sódio (NaOH) impuro foi dissolvida em água suficiente para formar 1 L de solução.
Uma alíquota de 10 mL dessa solução aquosa consumiu, numa titulação, 20 mL de solução aquosa de ácido clorídrico (HCl) de concentração igual 0,05 mol·L-1.
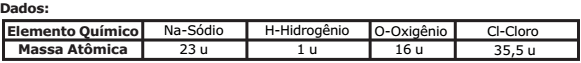
Admitindo-se que as impurezas do NaOH não reagiram com nenhuma substância presente
no meio reacional, o grau de pureza, em porcentagem, de NaOH na amostra é
I – MgO II – CO III – CO2 IV – CrO3 V – Na2O
Os óxidos que, quando dissolvidos em água pura, reagem produzindo bases são
São dadas as seguintes afirmativas:
I – Joseph J. Thomson, em seu modelo atômico, descrevia o átomo como uma estrutura na qual a carga positiva permanecia no centro, constituindo o núcleo, enquanto as cargas negativas giravam em torno desse núcleo;
II – um átomo, no estado fundamental, que possui 20 elétrons na sua eletrosfera, ao perder dois elétrons, gerará um cátion bivalente correspondente, com configuração eletrônica – segundo o diagrama de Linus Pauling – igual a 1s2 2s2 2p6 3s2 3p6;
III – a afinidade eletrônica (eletroafinidade) aumenta conforme o raio atômico diminui. Dessa forma, devido ao seu menor raio atômico, o oxigênio (Z=8) possui maior afinidade eletrônica do que o enxofre (Z=16), ambos pertencentes à mesma família da Tabela Periódica;
IV – o raio de um íon negativo (ânion) é sempre menor que o raio do átomo que lhe deu origem.
Das afirmações feitas, utilizando os dados acima, estão corretas apenas:
A água oxigenada ou solução aquosa de peróxido de hidrogênio ( H2O2) é uma espécie bastante utilizada no dia a dia na desinfecção de lentes de contato e ferimentos. A sua decomposição produz oxigênio gasoso e pode ser acelerada por alguns fatores como o incremento da temperatura e a adição de catalisadores. Um estudo experimental da cinética da reação de decomposição da água oxigenada foi realizado alterando-se fatores como a temperatura e o emprego de catalisadores, seguindo as condições experimentais listadas na tabela a seguir:

