Questões de Concurso Militar EsPCEx 2013 para Cadete do Exército - 1° Dia
Foram encontradas 12 questões
2 Al (s) + Fe2O3
 (s) 2 Fe (s) + Al2O3
(s) 2 Fe (s) + Al2O3(s) + calor
Reação de Termita
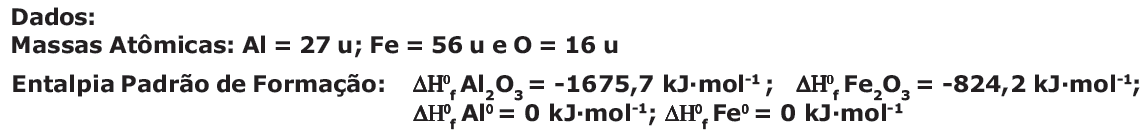
2 Al (s) + Fe2O3
 (s) 2 Fe (s) + Al2O3
(s) 2 Fe (s) + Al2O3(s) + calor
Reação de Termita
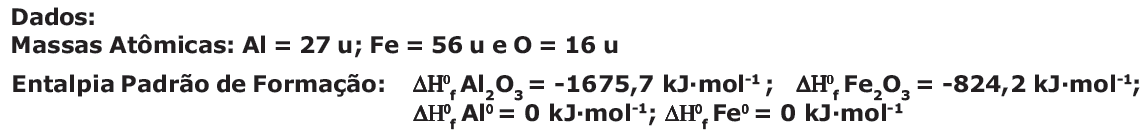
Baseado nessa reação, são feitas as seguintes afirmativas:
I – O sódio atua nessa reação como agente redutor.
II – A soma dos menores coeficientes inteiros que balanceiam corretamente a equação é 7.
III – Os dois produtos podem ser classificados como substâncias simples.
IV – Essa é uma reação de deslocamento.
Das afirmativas feitas, estão corretas:
Dados:
Massas Atômicas: C = 12 u; O = 16 u e H = 1u;
Volume molar nas condições padrão=24,5 L·mol-1 .
Os Curie continuaram a analisar os resíduos de uranimite e, em julho de 1898, obtiveram um extrato de bismuto quatrocentas vezes mais radioativo que o próprio urânio”. (Tio Tungstênio – memórias de uma infância química – Oliver Sacks – pag 257).
Considerando a meia vida do bismuto (214Bi), que é de 20 minutos, e uma amostra inicial de 100,0 g de 214Bi, a quantidade restante de 214Bi dessa amostra, que o casal Curie observaria, passada uma hora, seria de
nessa peça foi de
Dados:
massas atômicas Cr = 52 u e Cl = 35,5 u.
1 Faraday = 96500 C/mol de e-
Quando a temperatura cai, o reluzente estanho metálico exposto ao oxigênio do ar começa a se tornar friável e a se esboroar (desfazer) num pó acinzentado e não metálico - continua sendo estanho, mas com forma estrutural diferente”. (Adaptado de Os Botões de Napoleão - Penny Le Couteur e Jay Burreson - Pag 8).
Quando a temperatura cai, o reluzente estanho metálico exposto ao oxigênio do ar começa a se tornar friável e a se esboroar (desfazer) num pó acinzentado e não metálico - continua sendo estanho, mas com forma estrutural diferente”. (Adaptado de Os Botões de Napoleão - Penny Le Couteur e Jay Burreson - Pag 8).
I – o texto faz alusão estritamente a ocorrência de fenômenos físicos.
II – o texto faz alusão a ocorrência de uma reação de oxidação do estanho do botão.
III – o texto faz alusão a ocorrência de uma reação de síntese.
IV – o texto faz alusão a ocorrência de uma reação sem transferência de elétrons entre espécies estanho metálico e o oxigênio do ar.
Das afirmativas apresentadas estão corretas apenas:
Baseando-se nos potenciais padrão de redução das semi-reações a seguir, são feitas as seguintes afirmativas:
Sn 2+ (aq) + 2 e- → Sn (s) E0 red = - 0,14 V
Li+ (aq) + 1 e- → Li (s) E0 red = - 3,04 V
I-O estanho cede elétrons para o lítio.
II-O eletrodo de estanho funciona como cátodo da pilha.
III-A reação global é representada pela equação: 2 Li0 (s)+ Sn2+ (aq) → Sn0 (s) + 2 Li+ (aq)
IV-No eletrodo de estanho ocorre oxidação.
V-A diferença de potencial teórica da pilha é de 2,90 V, (∆E = + 2,90 V).
Das afirmativas apresentadas estão corretas apenas:
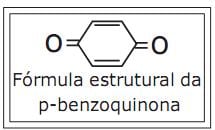
Acerca dessa substância química, são feitas as seguintes afirmativas:
I – O nome oficial, segundo a União Internacional de Química Pura e Aplicada (IUPAC), da p-benzoquinona é ciclohexa-2,5-dien-1,4-diona.
II – Sua fórmula molecular é C6H4O2.
III – Ela pertence a função fenol.
Das afirmativas feitas está(ão) correta(s) apenas: