Questões de Concurso Militar EsPCEx 2014 para Cadete do Exército - 1° Dia
Foram encontradas 11 questões
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro (Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2(g) → COCl2 (g).
Em um reator foram dispostos 560 g de monóxido de carbono e 355 g de cloro. Admitindo-se a reação entre o monóxido de carbono e o cloro com rendimento de 100 % da reação e as limitações de reagentes, a massa de fosgênio produzida é de
Dados:
- massas atômicas: C = 12 u ; Cl = 35,5 u; O = 16 u
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
Dados:
Energia de Ligação
C = O 745 kJ/mol
C
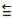 O 1080 kJ/mol
O 1080 kJ/mol C - Cl 328 kJ/mol
Cl - Cl 243 kJ/mol
Dados: 1H1; 6C12; 8O16; 16S32; 7N14
Cu (s) + HNO3 (aq) → Cu(NO3)2 (aq) + NO (g) + H2O (l)
Após o balanceamento da equação com os coeficientes estequiométricos (menores números inteiros) a soma destes coeficientes será igual a
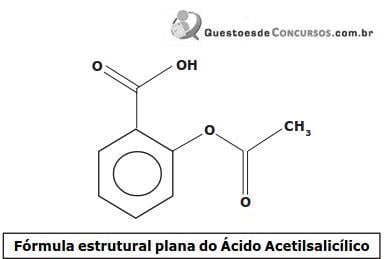
Considerando a fórmula estrutural plana simplificada do AAS, a alternativa que apresenta corretamente a fórmula molecular do composto e os grupos funcionais orgânicos presentes na estrutura é:
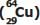 é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação
é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação  .
. Considerando uma amostra inicial de 128 mg de cobre-64, após 76,8 horas, a massa restante desse radioisótopo será de:
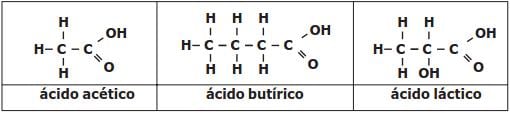
Com relação a estas substâncias citadas, são feitas as afirmativas abaixo.
I – Ácido Acético é a nomenclatura usual do composto que, segundo a nomenclatura oficial da União Internacional de Química Pura e Aplicada (IUPAC), é denominado de ácido metanóico.
II – As substâncias apresentadas possuem na estrutura grupos que caracterizam a função química ácido carboxílico.
III – O motivo de o ácido láctico apresentar maior ponto de fusão que o ácido butírico pode ser atribuído aos fatos de o ácido láctico ter maior massa molecular e de ser capaz de estabelecer maior número de fortes interações intermoleculares.
Dados:
- massas atômicas: C = 12 u ; H = 1 u; O = 16 u
Das afirmativas apresentadas está(ão) correta(s)
As equações que representam as semirreações de cada espécie e os respectivos potenciais- padrão de redução (25 ºC e 1 atm) são apresentadas a seguir.
Zn2+(aq) + 2 e- → Zn (s) Eo = - 0,76 V
Ag+ (aq) + 1 e- → Ag (s) Eo = + 0,80 V
Com base nas informações apresentadas são feitas as afirmativas abaixo.
I – No eletrodo de zinco ocorre o processo químico de oxidação.
II – O cátodo da pilha será o eletrodo de prata.
III – Ocorre o desgaste da placa de zinco devido ao processo químico de redução do zinco.
IV – O sentido espontâneo do processo será Zn+2 + 2 Ago → Zno + 2 Ag+
V – Entre os eletrodos de zinco e prata existe uma diferença de potencial padrão de 1,56 V.
Estão corretas apenas as afirmativas