Questões de Concurso Militar CAP 2013 para Cabo - Técnico em Química
Foram encontradas 45 questões
As pilhas ou baterias que possuem o lítio como principal constituinte têm como uma de suas características o fato de serem leves, pois o lítio é o metal menos denso descoberto até o momento.
Considere as semi-reações: Li (s) +1 + e-
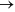 Li (s) E0 = -3, 05 V
Ag(aq)+1 + e-
Li (s) E0 = -3, 05 V
Ag(aq)+1 + e- 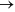 Ag (aq) E0 = +0,80 V
Ag (aq) E0 = +0,80 V
Se uma pilha é composta pelos dois elementos químicos acima, pode-se afirmar que o elemento que constitui o ânodo da reação eletroquímica espontânea e o Potencial da pilha são dados, respectivamente, por:
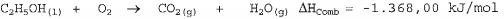
Sabendo-se que na combustão de certa quantidade de etanol houve a liberação de 456,00 kJ, é correto afirmar que a quantidade de oxigênio consumida na reação foi de:
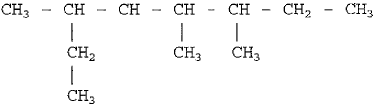
A nomenclatura oficial, segundo a IUPAC, do composto acima é dada por:
Dado: massa molar do Sulfato de Bário = 233 g/mol
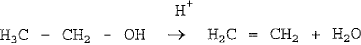
Na reação acima, o álcool etílico sofreu uma reação de

A tabela acima apresenta as cores que os indicadores possuem em diferentes valores de pH . A faixa de viragem indica em quais valores de pH ocorre a transição da cor em meio ácido para a cor em meio básico e vice-versa.
Em relação ao uso de indicadores na titrimetria, é correto afirmar que:
Considere a adição de 10 mL de ácido bromídrico [1M] a um litro de solução tampão, conforme abaixo:
Solução tampão: ácido acético [0,2M] + acetato de sódio [0,2M]
Sendo o aumento do volume desprezível, qual é o pH da solução tampão e o pH da solução resultante, respectivamente?
Dados: pKa do acido acético = 4,76
pH = pKa + log [sal] / [ácido]
log(0,9) = -0,05
I - O eletrodo de vidro não é um eletrodo de referência, pois é sensível ao pH.
II - O eletrodo indicador do primeiro tipo consiste de um metal em contato com uma solução contendo íons do próprio metal.
III- Um equipamento potenciomêtrico necessita de um eletrodo de referência, um eletrodo indicador e de um dispositivo para leitura de potencial.
Assinale a opção correta.
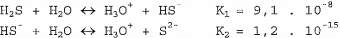
A constante de ionização total da reação pode ser expressa pela relação:

A tabela acima se refere à sensibilidade medida de um sensor de absorção em diferentes concentrações de uma solução. Sendo C a concentração molar da solução, S a sensibilidade medida e ss o desvio padrão, pode-se afirmar que, na concentração de 0,22M, o valor da sensibilidade de calibração (m) e a sensibilidade analítica (Y) são, respectivamente:
Dados: S = m.C + b e Y = m/ss, onde b é uma constante