Questões de Concurso Militar CAP 2014 para Cabo - Técnico em Química
Foram encontradas 50 questões
O cloreto de chumbo II é ligeiramente solúvel em água, conforme descrito na equação química abaixo.
PbCl2(s)  Pb2+(aq) + 2Cl-(aq)
Pb2+(aq) + 2Cl-(aq)
Sabendo que a concentração do íon chumbo, na solução saturada, é de 0,02 mol/L, qual é o valor do produto de solubilidade do cloreto de chumbo II?
Dados:
Produto de solubilidade
(Kps) : Kps = [Pb2+] [ Cl- ] 2
[Pb2+ ] : concentração do íon Pb2+
[Cl-] : concentração do íon Cl-
Observe a reação a seguir.
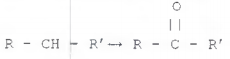
Álcoois podem ser oxidados, conforme indica a reação acima,
onde os radicais R e R' são grupos alquila não,
necessariamente, iguais. Conclui-se, portanto, que o
resultado desta oxidação é um composto de grupo funcional:
Analise as afirmativas abaixo, relacionadas aos compostos iônicos .
I - Apresentam elevados pontos de fusão e de ebulição.
II - São sólidos nas condições ambientes de temperatura e pressão.
III- Conduzem corrente elétrica quando dissolvidos em água.
IV - São exemplos de compostos iônicos: Cloreto de Sódio e Diamante.
Assinale a opção correta.
0 hidróxido de sódio (NaOH),também conhecido como soda cáustica, é muito utilizado na indústria como base química na fabricação de papel, tecidos e detergentes. Um técnico em química necessita saber o valor do pH de uma solução aquosa de NaOH, a qual será utilizada na fabricação de um grande lote de detergentes. Para tanto, recebeu uma amostra de 500mL da solução aquosa que contém 0,700g de NaOH. Qual o valor do pH da solução aquosa de NaOH?
Dados:
Constante de ionização da água
(Ka) = [H+ ] [OH-] = 1,0 . 10-14
[H+ ] : concentração do íon H+
[OH- ] : concentração do íon OH-
log (2,9) = 0,46 e log(3,5) = 0,54
Com relação às propriedades do grafite e do diamante, analise as afirmativas abaixo.
I - O grafite parcialmente oxidado é escorregadio e frequentemente utilizado como lubrificante.
II - A estrutura do diamante consiste em lâminas de carbono bidimensionais, conferindo-lhe a maior dureza conhecida .
III- O grafite e o diamante não são os únicos alótropos do carbono.
IV - O diamante é um bom isolante térmico.
Assinai e a opção correta.
Observe a reação a seguir.
NO2(g) + O3(g) → NO3(g) O2(g)
Dados a 25 °C :
Lei da velocidade: velocidade = k[NO2][O3]
Constante de velocidade (k) : k = 4,4 x 107 dm3 • mol-1 • s-1
[NO2] : concentração de dióxido de nitrogênio (NO2)
[O3] : concentração de ozônio (O3)
A reação química acima ocorre na atmosfera terrestre quando o dióxido de nitrogênio presente no ar poluído entra em contato
com o ozônio. Com relação a este fenômeno químico, é
correto afirmar que:
Observe a reação química abaixo.
Ca (OH)2 + CO2(g) → X + Y
A água de cal (hidróxido de cálcio) saturada é utilizada
para testar a presença de gás carbônico em uma mistura
gasosa. Ao borbulhar o gás carbônico, através da água de
cal, forma-se um precipitado branco (incógnita X) e outra
substância (incógnita Y ) . Quais as fórmulas químicas das
incógnitas X e Y representadas na reação acima, respectivamente?
Observe as configurações eletrônicas dos elementos químicos I, II e III em suas camadas de valência.
I - 3s2 3p1
II - 4s2 4p3
III- 4s2 4p5
Com base nas configurações eletrônicas desses três elementos químicos, assinale a opção correta.
Observe a figura a seguir.
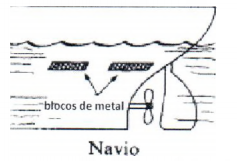
Para proteger da corrosão os cascos de navios, que são constituídos basicamente de ferro, é comum utilizarem-se blocos de um metal acoplados ao casco, conhecidos como metais de sacrifício, conforme representado na figura acima.
Dados:
Potenciais Padrão de Redução:
Fe2+ + 2e ↔ Fe E° = -0,44V
Cu2+ + 2e ↔ Cu E° = +0,34V
Zn2- + 2e ↔ Zn E° = -0,76V
Ni2+ + 2e ↔ Ni E° = -0,25V
Ag+ + e ↔ Ag E° = +0,79V
Pb2+ + 2e ↔ Pb E° = -0,13V
Utilizando os valores de potenciais acima relacionados, qual
é o metal de sacrifício que oferecerá melhor proteção ao
casco do os valores do navio?
Observe a tabela a seguir.
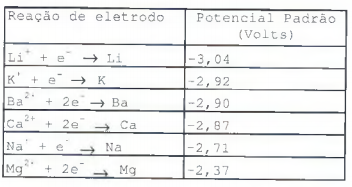
O potencial padrão de eletrodo é uma expressão quantitativa
da facilidade com que um elemento perde elétrons. A tabela
acima exibe valor do potencial padrão de eletrodos de metal.
Sendo assim, é correto afirmar que o agente redutor mais
forte do Cálcio é o:
Coloque V (verdadeiro) ou F (falso) nas afirmativas abaixo, com relação às vidrarias e aparelhagens utilizadas em laboratório, e assinale a opção que apresenta a sequência correta.
( ) As pipetas são instrumentos volumétricos utilizados para a transferência de certos volumes, de modo preciso, sob determinadas temperaturas.
( ) A bureta consiste em um recipiente em forma de pêra, de fundo chato, colo longo e estreito.
( ) As pipetas de transferência são tubos retos de diâmetro relativamente pequeno e sem bulbo central.
( ) Dessecadores são recipientes de vidro cobertos, destinados a estocagem de objetos em atmosfera seca.
( ) As câmaras secas são usadas na manipulação de materiais muito sensíveis à umidade atmosférica ou ao oxigênio.
Um mol de gás hidrogênio, a 27 °C em um sistema fechado, se expande isotermicamente contra uma pressão externa constante igual a 1 atm, até duplicar o seu volume inicial. Qual é o calor necessário para manter constante a temperatura do gás, sabendo que a pressão final do gás é 1 atm?
Dados : ΔU = Q - W
W = PextΔV
PV = nRT
T(K) = T(°C) + 273
R = 0,082 atm•L • mol-1 • K-1
1atm = 105 N • m-2
O cloro é um gás amarelo-esverdeado e foi preparado, pela primeira vez, pelo químico sueco Karl Wilhelm Scheele em 1774. A reação abaixo ocorre quando o gás cloro (Cl2) é dissolvido em uma solução aquosa básica:
Cl2(g) + 2OH- (aq) → OCl- (aq) + Cl- (aq) + H2O(I)
Assinale a opção que apresenta a nomenclatura correta dos íons OCl- e Cl- , respectivamente.