Questões de Concurso Militar CBM-PR 2019 para Aspirante do Corpo de Bombeiro
Foram encontradas 9 questões
Num laboratório, um grupo de alunos possui quatro semicélulas montadas, todas em condição padrão de concentração e temperatura, correspondentes às semirreações mostradas no quadro abaixo:
Semicélula Semirreação de redução E0 / V
I MnO2 + 4H+ + 2e- → Mn2+ + 2H2O 1,23
II I2 + 2e- → 2I- 0,54
III Cu2+ + 2e- → Cu 0,34
IV Zn2+ + 2e- → Zn -0,76
Numa dada combinação para montar uma pilha eletroquímica, o valor de diferença de potencial (ΔE) da pilha, no instante em que se ligaram os contatos, foi de 0,69 V.
A combinação utilizada nessa pilha foi entre as semicélulas:
As cetonas pertencem a uma classe de substâncias empregadas como reagente de partida na síntese de outros compostos orgânicos, contendo diferentes grupos funcionais. No esquema abaixo, estão indicadas cinco rotas de síntese, as quais fornecem cinco produtos diferentes, a partir de uma mesma cetona:
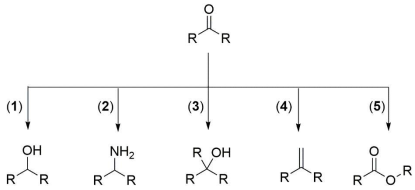
As rotas de síntese que geram produtos pertencentes a uma mesma classe de compostos orgânicos são:
O fogo causado pela queima de óleo de cozinha ou gordura é bem mais difícil de se apagar do que o de outros líquidos inflamáveis, o que demandou a criação dos extintores classe K. Tais extintores são preenchidos com uma solução alcalina que causa a saponificação do óleo ou gordura, produzindo uma espuma que abafa a chama. No quadro abaixo, são listadas as propriedades de cinco substâncias.
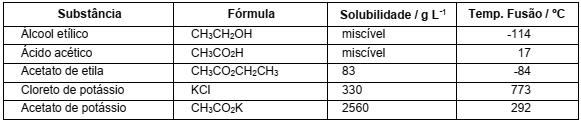
Qual das substâncias acima é a adequada para se preparar a solução de preenchimento desse tipo de extintor?
A estrutura química mostrada abaixo é a de um neurotransmissor que age como inibidor no sistema nervoso central. Quando esse neurotransmissor se liga ao seu receptor cerebral, experimenta-se um efeito calmante, que ajuda em casos de ansiedade, estresse ou medo. Trata-se de um γ-aminoácido comumente conhecido como GABA, do inglês Gamma AminoButyric Acid.
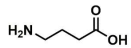
O nome desse composto, segundo a nomenclatura da IUPAC, é:
O ânion perxenato (XeO64- ) é um oxidante muito forte, capaz de oxidar Mn(II) a Mn(VII), conforme a equação química abaixo:
5 Na4XeO6(aq) + 8 MnSO4(aq) + 2 H2O(l) → 5 Xe(g) + 8 NaMnO4(aq) + 6 Na2SO4(aq) + 2 H2SO4(aq)
Além disso, o XeO64- é um oxidante limpo, pois não introduz produtos de redução no meio da reação, uma vez que o xenônio formado está na forma de gás.
Um experimento foi realizado na temperatura de 300 K e 100 kPa, em que 16 mol de MnSO4 foram totalmente oxidados por Na4XeO6 e todo o gás produzido foi coletado. Nessas condições, o volume de um mol de um gás ideal é igual a 24,9 L.
O volume (em L) de gás coletado nesse experimento foi igual a:
Os principais parâmetros que definem a qualidade da água de uma piscina são o pH e a alcalinidade. Para a água ser considerada própria, o pH deve ser mantido próximo de 7,0, para garantir o conforto do banhista e a eficácia dos agentes bactericidas. Já a alcalinidade, expressa em concentração de íon bicarbonato, deve ser em torno de 100 g m-3 . A propriedade anfotérica desse íon garante que qualquer substância ácida ou básica introduzida seja prontamente neutralizada, conforme mostram as equações químicas abaixo:
HCO3- (aq) + H+ (aq) ⇄ H2O(l) + CO2(g)
HCO3- (aq) + OH- (aq) ⇄ H2O(l) + CO32-(aq)
Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o
banho, ocorrerá:
Em 2019, é comemorado o aniversário de 150 anos da primeira versão da tabela periódica, proposta por Dmitri Mendeleev. Ele criou um sistema que, além de catalogar os elementos, permitiu prever propriedades em função da posição que o elemento ocupa na tabela. Em 1869, o sódio (Na) e o potássio (K) já constavam da primeira versão da tabela periódica. Na versão atual, esses elementos pertencem ao primeiro grupo, o dos metais alcalinos. Esses metais reagem de maneira violenta com água, na qual se produz gás hidrogênio, conforme esquematizado abaixo:
2 M (s) + 2 H2O (l) → 2 MOH (aq) + H2(g), M = Na ou K
A propriedade comum a esse grupo, que é responsável pelo comportamento descrito em água, é o:
Ao tentar identificar todas as possibilidades de fórmulas estruturais do composto 1,2-diclorociclo-hexano, um estudante propôs as quatro estruturas mostradas na figura abaixo. Entretanto, seu professor apontou que havia um engano, porque apenas três estruturas distintas são possíveis.
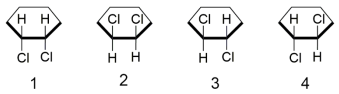
O estudante propôs uma estrutura a mais porque considerou em sua resposta que: