Questões Militares
Para segurança pública
Foram encontradas 6.706 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A lei que é usada para identificar o sentido da mudança espontânea, a segunda lei da termodinâmica, também se exprime em termos de uma função de estado, a entropia. A primeira lei usa a energia interna para identificar as mudanças permitidas; a segunda lei usa a entropia para identificar as mudanças espontâneas entre as mudanças permitidas.
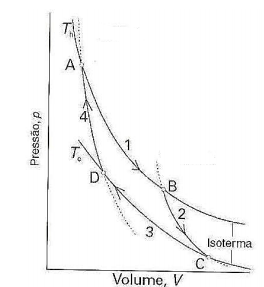
Sobre o ciclo de Carnot, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A variação de entropia é qh/Th, em que qh é a energia na forma de calor fornecida ao sistema pela fonte quente.
( ) Há troca de calor; a variação de entropia é nula.
( ) A variação de entropia do sistema é qc/Tc , qc é positivo.
( ) Não há troca térmica e, portanto, a variação de entropia é nula.
A sequência está correta em
Reações de oxidação e redução podem ocorrer em muitos sistemas químicos. Exemplos incluem nosso próprio sistema respiratório e o sistema fotossintético complementar nas plantas. Além disso, podemos pensar no processo de assar o pão, no enferrujamento do ferro, na ação dos alvejantes sobre as manchas e na produção e combustão do petróleo. Nesse contexto, analise as afirmativas a seguir.
I. O ∆G° para a reação NiO2(s) + 2Cl– (aq) + 4H+ (aq) → Cl2(g) + Ni2+(aq) + 2H2O, sabendo que o potencial padrão de pilha é 0,320 V a 25°C é –30,9 kJ.
II. 0,395 g de cobre são depositados no catodo de uma célula eletrolítica se uma corrente elétrica de 2,00 A passa por uma solução de CuSO4 por um período de 20 min.
III. Na eletrólise de solução aquosa de cloreto de sódio forma-se gás cloro no ânodo e gás hidrogênio no cátodo.
Está(ão) correta(s) apenas a(s) afirmativa(s)
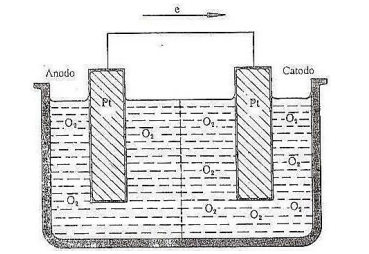 De acordo com a figura, analise as afirmativas a seguir.
I. O valor Epilha só será positivo se pO2(C) < pO2(A).
II. Admite-se que as pressões parciais do oxigênio seja 0,1 e 1 atm o Epilha é 0,01477 V.
III. Reação do anodo: 4 OH– → 2H2O + O2 (0,1 atm) + 4e.
Está(ão) correta(s) apenas a(s) afirmativa(s)
De acordo com a figura, analise as afirmativas a seguir.
I. O valor Epilha só será positivo se pO2(C) < pO2(A).
II. Admite-se que as pressões parciais do oxigênio seja 0,1 e 1 atm o Epilha é 0,01477 V.
III. Reação do anodo: 4 OH– → 2H2O + O2 (0,1 atm) + 4e.
Está(ão) correta(s) apenas a(s) afirmativa(s) 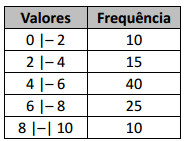
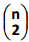 =15 então o valor de n é:
=15 então o valor de n é: