Questões Militares
Foram encontradas 1.250 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Internet: https://brasil.elpais.com/brasil/ (com adaptações).
Acerca de vacinação no combate ao sarampo, julgue o item a seguir.
A vacina tríplice acelular (DPaT), recomendada para a prevenção contra o sarampo, é eficaz por estimular a imunidade passiva nas pessoas.
A respeito de células eucariotas e procariotas, julgue o próximo item.
O peptideoglicano é um dos componentes que constituem a
parede celular na maioria dos seres procariontes; nas células
vegetais, essa parede é formada por celulose.
A respeito de células eucariotas e procariotas, julgue o próximo item.
Tanto as células eucariotas quanto as células procariotas
possuem material genético que pode ser localizado em uma
região denominada nucleoide.
Com base na situação hipotética apresentada, julgue o item seguinte.
A planta descrita por Maria é uma espécie vegetal
pertencente ao grupo das pteridófitas.
Com base na situação hipotética apresentada, julgue o item seguinte.
O muçuã avistado por Pedro é uma espécie de animal de
pequeno porte, com hábitos preferencialmente carnívoros,
pertencente ao grupo dos quelônios, cujos representantes
apresentam, em sua estrutura anatômica, uma armadura
óssea ou carapaça, que confere ao corpo proteção contra
choques mecânicos e ataques de predadores.

A oxidação total do composto 2 produz o seguinte composto.
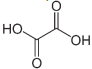

A massa molar do composto 1 é menor que 245,0 g/mol.

O composto 1 apresenta duas aminas terciárias.

O nome do composto 2 é etano-1,2-diol.
Na reação de dupla troca do (NH4)2SO4 com o CaCl2, um dos compostos gerados é o sulfato de cálcio, de fórmula CaSO4.
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Considere que a obtenção do NH4H2PO4 se dê pela reação do
ácido fosfórico (H3PO4) com a amônia (NH3) em uma reação
com 100% de rendimento. Nesse caso, para a obtenção de
120 kg de NH4H2PO4, são necessários menos de 100 kg de
ácido fosfórico.
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Os dois compostos apresentados no texto apresentam
ligações iônicas e ligações covalentes.
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Em uma solução de NH4H2PO4, de concentração 12,0 g/L, a
concentração em quantidade de matéria do elemento fósforo
é maior que 0,1 mol/L.
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
O número de oxidação do fósforo no di-hidrogenofosfato de
amônio é uma unidade maior que o número de oxidação do
enxofre no (NH4)2SO4.
Os íons sulfato e amônio no composto (NH4)2SO4 têm geometrias tetraédricas.
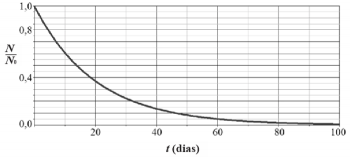
Considerando o gráfico apresentado, julgue o item a seguir.
A vida-média do elemento em questão é menor que 18 dias.

Para um potencial de corte de 4,55 V, o quadrado da velocidade máxima do fotoelétron é maior que 2 × 1013 m2 /s2 .

Em um gráfico do potencial de corte versus a frequência, a inclinação da reta independe da função trabalho do material em estudo.

Para que se possa medir o potencial de corte, o polo positivo da bateria deve ser b.

Se a luz estiver desligada e o resistor estiver na posição L/2,o potencial no voltímetro será igual a ε/3, em que ε representa a força eletromotriz da bateria.