Questões Militares
Foram encontradas 469 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Sabendo-se que 1 mol de Ag contém 6,022 x 1023 átomos de Ag e pesa 107,9g, qual é a massa, em gramas, de um átomo de prata?
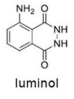
Tendo como referência a estrutura do luminol, apresentada anteriormente, e as informações do texto precedente, julgue o item a seguir, considerando que MH = 1 g/mol, MC = 12 g/mol, MN = 14 g/mol e MO = 16 g/mol.
Em 2 mols de moléculas de luminol, existem 14 × 1023
átomos de hidrogênio.
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Considere que a obtenção do NH4H2PO4 se dê pela reação do
ácido fosfórico (H3PO4) com a amônia (NH3) em uma reação
com 100% de rendimento. Nesse caso, para a obtenção de
120 kg de NH4H2PO4, são necessários menos de 100 kg de
ácido fosfórico.
Dados: fórmulas moleculares: metano: CH4; propano: C3H8; butano: C4H10; etanol: C2H6O; e metanol: CH4O.
Considerando a reação de combustão completa desses combustíveis, o que necessitará de maior quantidade de gás oxigênio por molécula de combustível é o