Questões Militares
Foram encontradas 514 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Constantes de equilíbrio de ácidos fracos a 25 oC

Com base nas informações fornecidas, qual dos sais indicados a seguir é o mais eficiente como solução neutralizante?
A fórmula mínima desse óxido é:
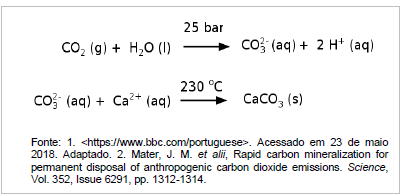
A remoção desse gás da atmosfera ocorre por:
Dados: massa atômica de cobre 64 u ; volume molar nas CNTP: 22,7 L