Questões Militares
Foram encontradas 519 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Em um experimento de química, um estudante colocou em um recipiente 500 mL de uma solução aquosa de hidróxido de sódio (NaOH) em uma chapa de aquecimento. O pOH da solução antes do aquecimento era igual a 2. Após um tempo, considerando que se evaporou apenas água, o pOH da solução se reduziu à metade.
Nessas condições, é correto afirmar que o volume, em mililitros, da solução que permaneceu no recipiente ao fim do experimento é igual a
Em condições ideais, pequenas quantidades de gás cloro podem ser geradas em laboratório pela reação do óxido de manganês (MnO2 ) com ácido clorídrico (HCl), conforme a equação química a seguir não balanceada.
HCl(aq) + MnO2 (s) → H2O(L) + MnCl2(s) + Cl2(g)
A partir dessas informações, quantas moléculas de gás cloro, aproximadamente, podem ser produzidas quando 10 g de óxido de manganês com grau de pureza de 87% são colocados para reagir completamente com excesso de ácido clorídrico?
Dado: Número de Avogadro (N) = 6 x 1023
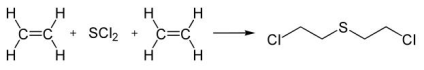
Sobre a equação de produção do gás mostarda, foram feitas a seguintes afirmações:
I. O eteno é um composto isomérico trans. II. O gás mostarda tem fórmula molecular C4H8SCl2 . III. A reação orgânica de produção do gás mostarda é de substituição.
São incorretas as afirmações
A nitroglicerina é um líquido oleoso de coloração amarela, levemente esverdeada, da classe dos explosivos, substâncias que se decompõem rapidamente, com expansão súbita de gases e grande liberação de energia. Possui massa molecular de 227g.mol-1 e sua temperatura não deve ultrapassar 30°C, nem ser exposta a choques mecânicos. A nitroglicerina é obtida através da nitração da glicerina, utilizando ácido sulfúrico como catalisador. A reação da decomposição da nitroglicerina pode ser escrita como:
4C3 H5 N3 O9(l) → 10H2O(g) + 6N2(g) + O2(g) + 12CO2(g)
Sabendo que a constante dos gases é igual a 8,314J.mol-1.K-1, a decomposição de 227g de nitroglicerina a
27°C e 1,01kPa, vai liberar cerca de quantos litros de gases?
“Quando um eletrólito é adicionado à água, independentemente se a solubilidade é alta ou baixa, ocorre a sua dissociação (liberação de íons) ou ionização (produção de íons). Porém, ao mesmo tempo, esses íons voltam a formar o eletrólito, ocorrendo um equilíbrio químico de dissolução.”
(Produto de solubilidade - Manual da Química (manualdaquimica.uol.com.br). Acesso em: 15/02/2018).
Considere os carbonatos apresentados na tabela abaixo e seus respectivos valores da constante de produto de solubilidade (Kps) a 25°C.

A partir dos dados da tabela, foram feitas as seguintes afirmações sobre as solubilidades molares.
I. Carbonato de zinco é mais solúvel do que carbonato de cádmio.
II. Carbonato de zinco é mais solúvel do que carbonato de prata.
III. Carbonato de prata é mais solúvel do que carbonato de cádmio.
É verdadeiro o que se afirma em: