Questões Militares
Foram encontradas 506 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
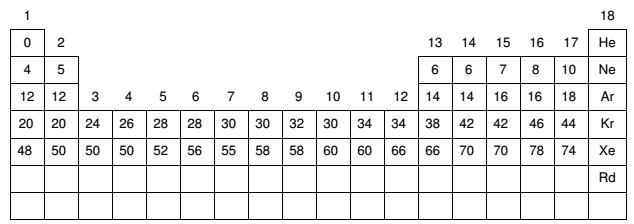
As moléculas ΦOF4, ΨF4 e ΩF5 apresentam, respectivamente, formas geométricas que se aproximam das figuras (1), (2) e (3), mostradas a seguir, no modelo de bola e palito:
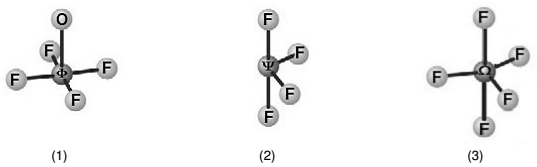
Sabendo-se que “Φ“, “Ψ” e “Ω” representam elementos da tabela periódica, assinale a alternativa correta que indica, na sequência, as possíveis identidades destes elementos:
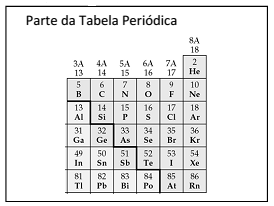
No esboço da Tabela Periódica abaixo estão discriminados os números de nêutrons dos isótopos mais estáveis de alguns elementos.
Considere agora um composto iônico binário, em que:
(i) o cátion, de carga +2, possui 12 prótons;
(ii) o ânion, de carga –3, possui 10 elétrons.
A massa de 1 mol deste composto é aproximadamente igual a:
O suor humano apresenta quantidades razoáveis de cloreto de sódio. Há, também , traços de ácido lático, entre outras substâncias. Quando tocamos algum objeto, deixamos nele nossas impressões digitais, que são impregnadas de suor e, portanto , impregnadas de cloreto de sódio. Para visualizar essas impressões, uma das maneiras é borrifar uma solução de nitrato de prata nos objetos analisados. Isso leva à formação de precipitado de cloreto de prata (reação I) que, por posterior fotólise, leva à formação de prata metálica, que revela as linhas da impressão digital na form a de um sólido de cor prateada (reação II). Observe as reações abaixo:
I: NaCl(s) + AgNO3(aq) → NaNO3(aq) + AgCl(s)
II: 2AgCl(s) → 2 Ag(s) + Cl2(g)
As reações apresentadas são classificadas, respectivamente, como: