Questões Militares
Foram encontradas 469 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
2. HCOONa + H2SO4 → 2HCOOH + Na2SO4
Uma solução aquosa foi preparada a partir da dissolução de 6,8 g de metanoato de sódio em 100 ml de água. Essa solução preparada reagiu com uma solução de ácido sulfúrico com centração de 0,2 mol/L para formação do ácido fórmico. Sabendo que a quantidade de solução de ácido sulfúrico foi a quantidade estequiométrica para completar a reação de síntese, a concentração da solução de metanoato de sódio preparada e a quantidade de solução de ácido sulfúrico adicionada, respectivamente, foram:
Massa molar: Na=23 g/mol; C=12 g/mol; O=12 g/mol; O=16 g/mol; H=1 g/mol
Foi adicionada a uma bomba calorimétrica selada, com volume invariável a 25 ºC, uma mistura gasosa de um hidrocarboneto saturado e oxigênio, com pressão total P1 , em proporção estequiométrica para reação de combustão completa.
Após acionada a ignição, a mistura gasosa reagiu completamente. Considerando que o volume do líquido formado na reação é desprezível em relação ao volume total do compartimento e que a pressão P2 no interior da bomba calorimétrica após a reação 25 ºC é igual a 0,5 x P1 , a fórmula molecular do hidrocarboneto empregado no experimento é:
A bateria de Thomas Edison desenvolvida no século 19 é um dispositivo eletroquímico que funciona de acordo com o esquema simplificado representado na figura. No sentido da descarga, o potencial fornecido por par de eletrodos é igual a +1,35V
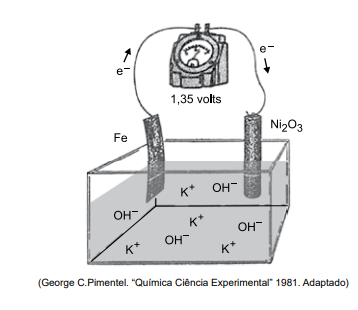
Considere as informações:
Semirreação Potencial padrão de redução (Eº)
I. Fe(OH)2 (s) + 2e– → Fe(s) + 2OH– (aq) X
II. Ni2O3(s) + 3H2O (l) + 2e– → 2Ni(OH)2(s) + 2OH–
(aq) +0,48V
Na bateria de Thomas Edison em operação no sentido da descarga, o eletrodo em que se processam a oxidação e o
potencial padrão de redução da equação I são: