Questões Militares Comentadas por alunos sobre transformações químicas em química
Foram encontradas 407 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
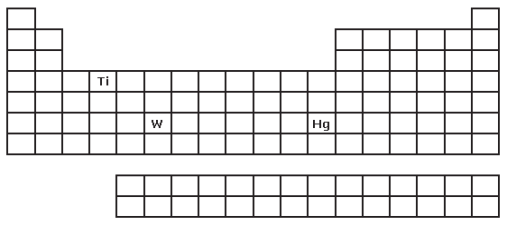
I) É freqüentemente usado em lâmpadas incandescentes, tem elevado ponto de fusão e número atômico igual 74.
II) É líquido nas condições ambiente (25º C e 1 atm) e utilizado em barômetros, em lâmpadas especiais e em odontologia.
III) Possui número atômico 22 e está na família 4 da Tabela Periódica. Algumas de suas utilizações podem ser assim exemplificadas: aplicação de próteses em joelhos e quadris; colocação de pinos para fixação entre a mandíbula e a prótese dentária.
Os metais descritos em I, II e III são, respectivamente:
F > Cl > Br > I > S
Fila de Reatividade dos Ametais
Analisando a Fila de Reatividade acima, a equação que representa a reação química que ocorre espontaneamente é:
Be(g) + E1 → Be(g)+ + e-
Mg(g) + E2 → Mg(g)+ + e-
Sr(g) + E3 → Sr(g)+ + e-
Sabendo-se que:
E1 representa o valor da primeira energia de ionização (1ª E.I.) do átomo de Be;
E2 representa o valor da primeira energia de ionização (1ª E.I.) do átomo de Mg;
E3 representa o valor da primeira energia de ionização (1ª E.I.) do átomo de Sr.
Pode-se afirmar que, ocorridas as transformações, a relação entre os valores E1, E2 e E3 será:
I - No modelo de Dalton, o átomo é dividido em prótons e elétrons.
II - No modelo de Rutherford, os átomos são constituídos por um núcleo muito pequeno e denso e carregado positivamente. Ao redor do núcleo estão distribuídos os elétrons, como plane- tas em torno do Sol.
III - O físico inglês Thomson afirma, em seu modelo atômico, que um elétron, ao passar de uma órbita para outra, absorve ou emite um quantum (fóton) de energia.
Das afirmações feitas, está(ão) correta(s)
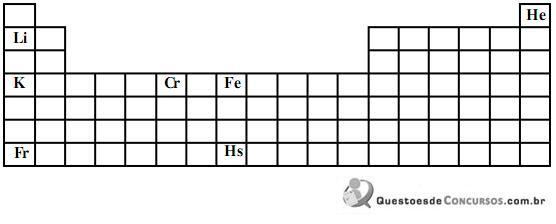
Sobre tais elementos químicos, assinale a alternativa correta.