Questões Militares
Foram encontradas 1.482 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Para converter o composto inorgânico de carbono mencionado em metano (CH4), a variação do NOX no carbono é de:
Sendo o cálcio pertencente ao grupo dos alcalinos terrosos e possuindo número atômico Z = 20, a configuração eletrônica do seu cátion bivalente é:
• Sobre volume de meio copo (~100 mL) do extrato líquido, adicionaram-se 20 mL de solução salina de cloreto de sódio (1 mol L -1 ). A cor roxa do extrato foi mantida.
• Sobre volume de meio copo do extrato líquido, adicionou-se suco de um limão. A cor do extrato líquido se tornou vermelha.
Foi observado aspecto opaco (turvo) no extrato líquido logo em seguida à sua separação das folhas de repolho, e esse aspecto se manteve durante todos os experimentos.
Sobre esse experimento, considere as seguintes afirmativas:
1. A mudança de cor de roxa para vermelha no segundo experimento é evidência de que ocorreu uma transformação química no extrato.
2. O extrato líquido é uma mistura homogênea.
3. Nos 20 mL de solução salina existem 1,2 x 1022 íons Na+ e 1,2 x 1022 íons Cl– .
Assinale a alternativa correta.
A tabela a seguir apresenta algumas informações a respeito de alguns ácidos graxos.
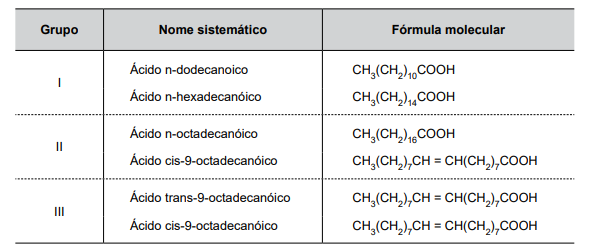
Dentro de cada grupo, I, II e III, os ácidos graxos que apresentam os pontos de fusão mais altos são, correta e respectivamente:
Na figura, é apresentada a fórmula de Haworth para a forma hemiacetálica cíclica de um monossacarídeo.
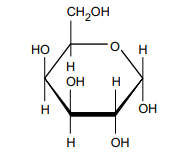
Trata-se de uma __________ e a conformação do átomo de carbono anomérico é _________ . Em relação à sua estrutura de cadeia aberta, a ciclização ocorreu entre os átomos de carbono de números _____________ .
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
Foi adicionada a uma bomba calorimétrica selada, com volume invariável a 25 ºC, uma mistura gasosa de um hidrocarboneto saturado e oxigênio, com pressão total P1 , em proporção estequiométrica para reação de combustão completa.
Após acionada a ignição, a mistura gasosa reagiu completamente. Considerando que o volume do líquido formado na reação é desprezível em relação ao volume total do compartimento e que a pressão P2 no interior da bomba calorimétrica após a reação 25 ºC é igual a 0,5 x P1 , a fórmula molecular do hidrocarboneto empregado no experimento é:
Foram misturados sob agitação Ag2S sólido e uma solução de saturada de H2S (0,1 mol/L) em H+ (0,15 mol/L).
Considerem-se as constantes de equilíbrio a 25 ºC:
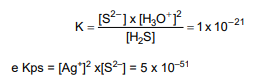
Nessa temperatura, ao se atingir o equilíbrio, a concentração de íons Ag+ na solução será:
Um procedimento para obtenção de estanho metálico foi realizado a partir do óxido de estanho (IV), em um compartimento selado que, após ser evacuado, foi preenchido com gás hidrogênio. Ao ser atingido o equilíbrio químico a 900 K, a atmosfera gasosa no interior do compartimento era composta por 45% gás hidrogênio, em volume.
A constante de equilíbrio, Kp, para essa reação a 900 K é igual a, aproximadamente,
A bateria de Thomas Edison desenvolvida no século 19 é um dispositivo eletroquímico que funciona de acordo com o esquema simplificado representado na figura. No sentido da descarga, o potencial fornecido por par de eletrodos é igual a +1,35V
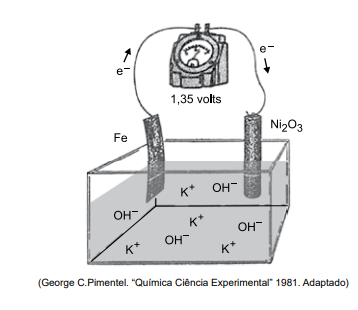
Considere as informações:
Semirreação Potencial padrão de redução (Eº)
I. Fe(OH)2 (s) + 2e– → Fe(s) + 2OH– (aq) X
II. Ni2O3(s) + 3H2O (l) + 2e– → 2Ni(OH)2(s) + 2OH–
(aq) +0,48V
Na bateria de Thomas Edison em operação no sentido da descarga, o eletrodo em que se processam a oxidação e o
potencial padrão de redução da equação I são:
Uma solução aquosa de cianeto de sódio foi adicionada a uma solução aquosa de permanganato de potássio, em meio básico. Assim, foram formados o óxido de manganês (IV) sólido e o íon cianato, CNO– .
Na semirreação envolvendo um mol do íon cianeto há a participação de ________ elétrons.
No balanceamento da equação global da reação envolvendo 2 mol do íon permanganato, participam _______ de íons hidroxila representados no lado dos _______ da equação de reação.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
A fosfina, PH3 , é uma substância gasosa em temperatura ambiente que pode ser obtida a partir da reação do fosfeto de cálcio sólido com água. Nessa reação, forma-se também o hidróxido de cálcio.
Uma certa massa de fosfeto de cálcio foi adicionada em água em um béquer aberto totalizando uma mistura reacional com massa igual a 1.000 g. Ao término da reação com consumo total do fosfeto de cálcio, a massa da mistura no interior do béquer era igual a 796 g.
A massa de água da mistura reacional no béquer era igual a
Três líquidos foram aquecidos em recipientes abertos, sob as mesmas condições de taxa de aquecimento e de pressão ambiente. O líquido 1 é água destilada; o líquido 2 é uma solução aquosa de cloreto de potássio 0,1 mol/L; e o líquido 3 é uma solução aquosa de nitrato de alumínio 0,1 mol/L.
Ao atingirem a temperatura de ebulição, comparando-se suas pressões de vapor, tem-se, corretamente, que:
Dois cilindros mantidos sob a mesma temperatura contêm gases puros, sendo ozônio no cilindro 1 e dióxido de enxofre no cilindro 2. A capacidade volumétrica do cilindro 2 é igual à metade da capacidade volumétrica do cilindro 1. Os dois gases estão sob a mesma pressão.
A relação entre a massa de gás do cilindro 1 e a massa de gás do cilindro 2 é igual a:
São apresentadas as configurações eletrônicas no estado fundamental de três elementos químicos:
I. [Ne] 3s2 3p1
II. [Ar]3s2
III. [Ne]3s2 3p5
A respeito desses elementos químicos, é correto afirmar que, dentre eles,
Uma das pesquisas realizadas no século 19, que foi de grande importância para o desenvolvimento dos modelos atômicos, empregava um dispositivo conhecido como ampola ou tubo de Crookes.
Com esse tipo de dispositivo, foram estudados os raios catódicos, que eram de fato ----------- que se direcionavam para o polo ----------- do tubo.
As lacunas são preenchidas, correta e respectivamente, por
Na tabela a seguir são apresentadas as densidades de três sólidos poliméricos e de três líquidos.
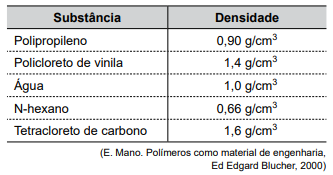
A figura seguinte representa o resultado da mistura de algumas amostras das substâncias apresentadas na tabela.
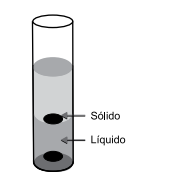
Considerando que não ocorreu reação entre os componentes do experimento, o sólido e o líquido indicados
pelas setas são, correta e respectivamente:
2 H2(g) + O2(g) → 2 H2O(g)
Nessa reação, o hidrogênio reage com o oxigênio em proporção 1:8 (em massa).
A esse respeito, analise as afirmativas a seguir.
I. A combustão completa de 5g de hidrogênio requer 40g de oxigênio.
II. A mistura de 4g de hidrogênio com 16g de oxigênio deverá gerar 20g de água.
III. A combustão de 2g de hidrogênio gera 2g de água.
Está correto o que se afirma em


2NH3 + CO2 ➝ NH2C(O)ONH4
NH2C(O)ONH4 ➝ (NH2)2CO + H2O
As etapas são, respectivamente, classificadas como reações de


a KMnO4 + b FeSO4 + c H2SO4 → d Fe2(SO4)3 + e K2SO4 + f MnSO4 + g H2O
A soma dos coeficientes estequiométricos (a + b + c + d + e + f + g) que tornam a equação balanceada é igual a


Assinale a opção que apresenta um óxido que pode contribuir para a formação de chuvas ácidas.