Questões Militares
Foram encontradas 60 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A equação de Bernoulli descreve o comportamento de um fluido que se move ao longo de um tubo ou conduto, podendo ser utilizada para calcular a velocidade da água.
A equação pode ser escrita: 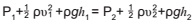 , em que:
, em que:
υ = velocidade do fluido ao longo do conduto.
g = aceleração da gravidade.
h = altura em relação a um referencial.
P = pressão ao longo do recipiente.
ρ = massa específica do fluido.
Considerando que uma represa retira a água em um grande lago artificial, sabe-se que o volume retirado é insignificante. Assim sendo, se a barragem tem um pequeno buraco a 1,4m abaixo da superfície do lago, a que velocidade a água sai do buraco?
Analise as Leis da Termodinâmica relacionadas por PW Atkins (2009), em seu livro Físico‐Química.
I. A entropia do universo tende a aumentar.
II. A energia interna de um sistema isolado é constante.
III. A velocidade de variação de momento é igual à força.
IV. As entropias de todas as substâncias perfeitamente cristalinas são as mesmas em T = 0.
É descrita como a Segunda Lei da Termodinâmica apenas a afirmativa
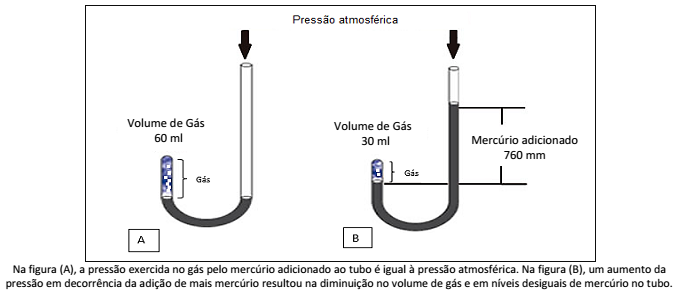
Essa imagem evidencia a relação inversa existente entre a pressão e o volume. Essa teoria se aplica à lei (de):
“A termodinâmica química estuda, entre outras coisas, as mudanças de energia que acompanham as reações químicas.”
(Fundamentos de Química Experimental, Maurício Gomes Constantino.)
Em relação à termoquímica, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A máxima quantidade de energia que um sistema químico pode produzir é medida pela variação de energia livre: ΔG.
( ) Na entalpia da transformação, as medidas são geralmente efetuadas não mantendo uma pressão constante e é representada como ΔH.
( ) Uma reação na qual o calor é absorvido (a temperatura da mistura de reação diminui quando reage) é chamada de endotérmica e o ΔH é positivo.
( ) Uma reação na qual o calor é perdido pelos reagentes para o meio ambiente (a temperatura da mistura de reação aumenta quando reage) é dita exotérmica, onde ΔH é negativo.
A sequência está correta em
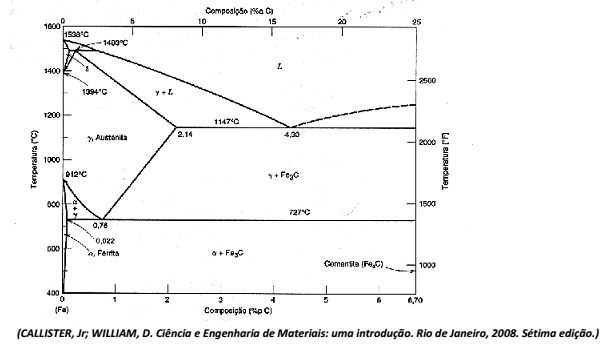
Para um aço contendo 81% de perlita, as porcentagens de ferrita e cementita são, respectivamente:
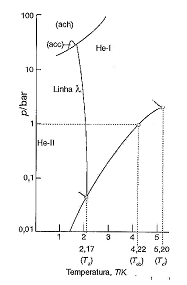
Sobre o diagrama de fases do hélio (4He), analise as afirmativas a seguir.
I. A linha λ assinala as condições para as quais a fase líquida e a fase sólida do hélio estão em equilíbrio. II. O He-II é um superfluido. III. As identificações ach e acc referem-se a fases sólidas distintas com estruturas diferentes do agrupamento dos átomos: uma delas é o agrupamento compacto hexagonal, ach; e a outra, o agrupamento compacto cúbico, acc.
Está(ão) correta(s) apenas a(s) afirmativa(s)
Alguns fatores ocorrem naturalmente, outras não. Um gás, por exemplo, se expande até ocupar todo o volume disponível que lhe é oferecido. Um corpo quente se resfria até atingir a temperatura das suas vizinhanças, e uma reação química avança preferencialmente num sentido e não no sentido inverso. O reconhecimento da existência de duas classes de processos, os espontâneos e os não espontâneos, é resumido pela Segunda Lei da Termodinâmica. Sobre o tema, analise as afirmativas a seguir.
(Considere: ln 2 = 0,69.
ln 2,8 = 1,03.)
I. A variação de entropia de um gás perfeito quando ele se expande isotermicamente do volume Vi até o volume Vf é 8,62 JK–1
II. A variação de entropia do argônio, que está inicialmente a 25°C e 1,00 bar, num recipiente de 0,500 dm3 de volume e que se expande até o volume de 1,000 dm3 , sendo simultaneamente aquecido até 100°C é 0,173 JK–1 .
III. Num ciclo termodinâmico, a variação global de uma função de estado (do estado inicial até o estado final e então de volta para o estado inicial) é igual a zero.
Está(ão) correta(s) apenas a(s) afirmativa(s)
CONSTANTES

DEFINIÇÕES


Um motor pulso-jato é uma máquina térmica que pode ser representada por um ciclo termodinâmico ideal de três etapas:
I. Aquecimento isocórico (combustão).
II. Expansão adiabática (liberação de gases).
III. Compressão isobárica (rejeição de calor a pressão atmosférica).
Considerando que essa máquina térmica opere com gases ideais, indique qual dos diagramas pressão versus volume a seguir representa o seu ciclo termodinâmico.
CONSTANTES

DEFINIÇÕES


Observe as figuras a seguir.
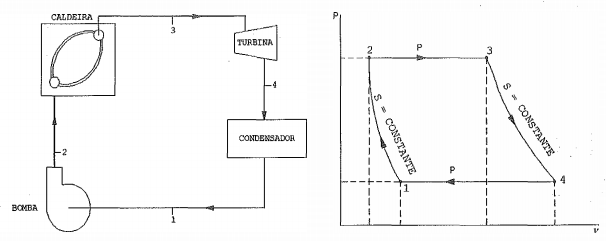
No ciclo ideal Rankine acima representado, o vapor d ’água deixa a caldeira e entra na turbina como vapor superaquecido a 5MPa e 500°C. A pressão no condensador é de 25kPa. Admita que os processos desse ciclo ocorram em regime permanente e com variações desprezíveis de energias cinética e potencial. Nessas condições e utilizando o critério de arredondamento na primeira casa decimal, calcule o rendimento do ciclo e assinale a opção correta.
Dados:

Considere um equipamento condicionador de ar operando segundo um ciclo de Carnot para manter um ambiente a 27°C„ A carga térmica a ser removida desse ambiente interno é de 6000W„ Sabendo que o ambiente externo está a 37 °C, determine a potência mínima (em W) necessária para acionar esse equipamento, e assinale a opção correta.
Dado :
T(K) = T(°C)+273
Analise a equação a seguir.
ΔU = q + w
A primeira Lei da Termodinâmica estabelece que a energia
interna de um sistema pode ser expressa pela equação acima.
Com base nos princípios da Termodinâmica e nessa equação,
assinale a opção correta.
Um mol de gás hidrogênio, a 27 °C em um sistema fechado, se expande isotermicamente contra uma pressão externa constante igual a 1 atm, até duplicar o seu volume inicial. Qual é o calor necessário para manter constante a temperatura do gás, sabendo que a pressão final do gás é 1 atm?
Dados : ΔU = Q - W
W = PextΔV
PV = nRT
T(K) = T(°C) + 273
R = 0,082 atm•L • mol-1 • K-1
1atm = 105 N • m-2
A figura apresentada a seguir representa um diagrama de equilíbrio de fases (hipotético) das ligas A-B.
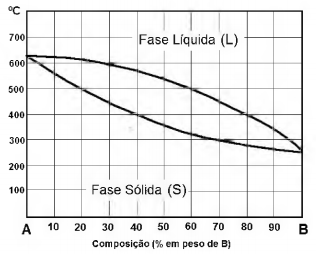
Uma determinada peça composta da liga A-B foi aquecida em condições de equilíbrio até a temperatura de 500°C e
fundiu parcialmente. Sabendo que nesta temperatura a fase sólida possui 80kg do elemento químico B e a fase
líquida possui 40kg do elemento químico A, qual é a percentagem em peso de B da liga que compõe essa peça?
Considere as supostas variações de entropia (∆S) nos processos abaixo:
I) cristalização do sal comum (∆S > 0)
II) sublimação da naftalina (naftaleno ) ( ∆S > 0)
III) mistura de água e álcool ( ∆S < 0)
IV) ferro (s) ferro (l) ( ∆S > 0)
ferro (l) ( ∆S > 0)
V) ar  ar comprimido (∆S < 0)
ar comprimido (∆S < 0)
As variações de entropia indicadas nos processos que estão corretas são: