Questões Militares
Comentadas para espcex
Foram encontradas 936 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O ácido etanoico, também denominado usualmente de ácido acético, é um ácido orgânico e uma das substâncias componentes do vinagre. Considerando-se a substância ácido etanoico, pode-se afirmar que:
I – É um composto cuja fórmula molecular é C2H6O.
II – Possui apenas ligações covalentes polares entre seus átomos.
III – Possui um carbono com hibridização sp2.
IV – Possui dois carbonos assimétricos (quiral).
V – O anidrido etanoico (acético) é isômero de cadeia do ácido etanoico (acético).
VI – Pode ser obtido pela oxidação enérgica do but-2-eno em presença do permanganato de potássio e ácido concentrado.
VII – Em condições adequadas, sua reação com sódio metálico produz etanoato de sódio e libera H2.
Das afirmativas feitas, estão corretas apenas
Modelo Característica(s) do Modelo I Átomo contém espaços vazios. No centro do átomo existe um núcleo muito pequeno e denso. O núcleo do átomo tem carga positiva. Para equilíbrio de cargas, existem elétrons ao redor do núcleo. II Átomos maciços e indivisíveis. III Elétrons movimentam-se em órbitas circulares em torno do núcleo atômico central. A energia do elétron é a soma de sua energia cinética (movimento) e potencial (posição). Essa energia não pode ter um valor qualquer, mas apenas valores que sejam múltiplos de um quantum (ou de um fóton). Os elétrons percorrem apenas órbitas permitidas.
A alternativa que apresenta a correta correlação entre o cientista proponente e o modelo atômico por ele proposto é
Gases apresentam um fenômeno chamado de difusão de gases.
“Difusão gasosa é o movimento espontâneo das partículas de um gás de se espalharem uniformemente em meio das partículas de um outro gás ou de atravessarem uma parede porosa.
Quando gases diferentes (A e B) estão a uma mesma temperatura, para uma quantidade de matéria igual a 1 mol de gás A e 1 mol de gás B, tem-se que a massa do gás A (ma) será igual à massa molar do gás A (Ma), e a massa do gás B (mb) será igual à massa molar do gás B (Mb).”
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007,
Pág. 110
Considere que, em determinadas condições de temperatura e pressão, a velocidade de difusão de 1 mol do gás hidrogênio (H2) seja de 28 km/min. Nestas mesmas condições a velocidade (em km/h) de 1 mol do gás metano (CH4) é de
Dado: √2 = 1,4
“No fenômeno físico, a composição da matéria é preservada, ou seja, permanece a mesma antes e depois da ocorrência do fenômeno”.
“Reação química é toda transformação que modifica a natureza da matéria (fenômenos químicos)”.
“No fenômeno químico, a composição da matéria é alterada: sua composição antes de ocorrer o fenômeno é diferente da que resulta no final”.
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 24 e 61.
Considere os conceitos supracitados e as transformações representadas pelas equações químicas a seguir:
I – CaCO3 (s) → CaO (s) + CO2 (g)
II – H2O (l) →H2O (g)
III – H2 (g) + O2 (g) → H2O (g)
IV – C(grafite) + O2 (g) → CO2 (g)
Correspondem a reações químicas apenas as transformações
“Solução saturada: solução que contém a quantidade máxima de soluto em determinada quantidade de solvente, a determinada temperatura; a relação entre quantidades máximas de soluto e quantidade de solvente é denominada de coeficiente de solubilidade”.
“Solução insaturada: quando a solução contém uma quantidade de soluto inferior ao seu coeficiente de solubilidade, na temperatura em que se encontra a solução”.
“Solução supersaturada: quando a solução contém uma quantidade de soluto dissolvido superior ao seu coeficiente de solubilidade, na temperatura em que se ela se encontra. É instável” .
USBERCO, João e SALVADOR, Edgard, Físico-química, São Paulo, Ed Saraiva, 2009, Pág. 18
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 18 e 19.
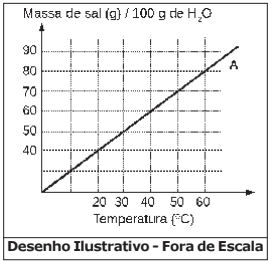
Considere o gráfico da curva de solubilidade em função da temperatura para um sal hipotético A. No gráfico, a linha contínua representa a solubilidade máxima do soluto (sal A) em 100 g de água na temperatura correspondente.
Acerca desse gráfico e processo de solubilidade são feitas as seguintes afirmativas:
I – Na temperatura de 20 ºC, misturando-se 50 g do sal A em 100 g de água, ter-se-á um sistema heterogêneo.
II – Na temperatura de 40 ºC, a adição de 50 g do sal A em 100 g de água produzirá uma solução insaturada.
III – 200 g de água dissolvem totalmente 90 g do sal A a 30 ºC.
IV – Uma solução contendo 60 g do sal A em 100 g de água será saturada em 60 ºC.
Das afirmativas feitas estão corretas apenas
O carbeto de cálcio, de fórmula CaC2 , é muito comum em equipamentos usados por exploradores de cavernas para fins de iluminação. Ele reage com água e gera como um dos produtos o gás acetileno (etino), de fórmula C2H2, conforme mostra a equação, não balanceada, a seguir
CaC2 (s) + H2O (l) → C2H2 (g) + Ca(OH)2 (s) (equação 1)
Sequencialmente, esse gás inflamável pode sofrer uma reação de combustão completa, liberando intensa energia, conforme a equação, não balanceada, a seguir
C2H2 (g) + O2 (g) → CO2 (g) + H2O (g) + calor (equação 2)
Uma massa de 512 g de carbeto de cálcio com pureza de 50% (e 50% de materiais inertes) é tratada com água, obtendo-se uma certa quantidade de gás acetileno. Esse gás produzido sofre uma reação de combustão completa.
Considerando a reação de combustão completa do acetileno nas condições ambientes (25ºC e 1 atm), o volume de gases obtidos e o valor da energia liberada como calor nessa reação, a partir da massa original de carbeto de cálcio, são, respectivamente,
Dados:
– volume molar na condição ambiente = 24,5 L · mol-1 (25ºC e 1 atm); calor de combustão do etino = -1298 kJ · mol-1 ; e
– constante universal dos gases R=0,082 L · atm · mol-1 · K-1 .
O fósforo branco, de fórmula P4, é uma substância bastante tóxica. É utilizado para fins bélicos como arma química de guerra em granadas fumígenas. Pode ser obtido a partir do aquecimento do fosfato de cálcio, areia e coque em um forno especial, conforme mostrado na equação balanceada da reação:
2 Ca3(PO4)2 (s) + 6 SiO2 (s) + 10 C (s) → 6 CaSiO3 (s) + 1 P4 (s) + 10 CO (g)
A respeito da reação de obtenção do fósforo branco, seus participantes e suas características são feitas as seguintes afirmativas.
I – O fósforo branco é classificado como uma substância iônica polar.
II – O fósforo branco (P4 ) é classificado como uma substância simples.
III – A geometria da molécula do gás monóxido de carbono é angular.
IV – A massa de fósforo branco obtida quando se aquece 1860 g de fosfato de cálcio com rendimento de 80% é de 297,6 g.
V – A distribuição eletrônica do átomo de cálcio no estado fundamental é: 1s2 2s2 2p6 3s2 3p5.
Das afirmativas feitas estão corretas apenas
O oxalato de cálcio é oxidado por permanganato de potássio em meio ácido. A equação não balanceada dessa reação é representada a seguir:
CaC2O4 + KMnO4 + H2SO4 → CaSO4 + K2SO4 + MnO2 + H2O + CO2
A soma dos coeficientes da equação da reação corretamente balanceada (menores números inteiros) e o volume de CO2 liberado quando se faz reagir 384 g de oxalato de cálcio por reação completa, na condição ambiente (25 ºC e 1 atm), são, respectivamente
Dados:
– volume molar nas condições ambiente de temperatura e pressão (25 ºC e 1 atm): 24,5 L · mol-1 ; e
– constante universal dos gases R=0,082 L · atm · mol-1 · K-1 .
Em química orgânica existem várias apresentações de fórmulas, como fórmulas moleculares e percentuais. A fórmula molecular indica o número de átomos de cada elemento em uma molécula da substância. A fórmula percentual indica a porcentagem, em massa, de cada elemento que constitui a substância. Uma maneira de determinação dessa fórmula é a partir da fórmula molecular, aplicando-se conceitos de massa atômica e massa molecular.
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 114
Tratando-se da estrutura e fórmula molecular, aldeídos são substâncias orgânicas que apresentam em sua estrutura o grupo carbonila ligado a um átomo de hidrogênio, na ponta de uma cadeia carbônica.
Considere os seguintes aldeídos: metanal; etanal; propanal; 3-metilbutanal e 2-metilbutanal.
Baseado nas fórmulas moleculares dos compostos citados, o aldeído que apresenta, em sua
fórmula percentual, aproximadamente 54,5 % em massa de carbono (C) na sua estrutura é o
O desenho abaixo apresenta uma barra metálica ABC em formato de L de peso desprezível com dimensões AB = 0,8 m e BC = 0,6 m, articulado em B por meio de um pino sem atrito e posicionada a 45° em relação à linha horizontal.
Na extremidade A é presa uma esfera homogênea de volume igual a 20 L e peso igual a 500 N
por meio de um fio ideal tracionado. A esfera está totalmente imersa, sem encostar no fundo de um recipiente com água, conforme o desenho abaixo. O valor do módulo da força  que faz 90°
com o lado BC e mantém o sistema em equilíbrio estático, como o desenho abaixo é:
que faz 90°
com o lado BC e mantém o sistema em equilíbrio estático, como o desenho abaixo é:
Dados: densidade da água: 1000 kg/m3
aceleração da gravidade: 10 m/s2
sen 45°= √2/2 e cos 45°= √2/2
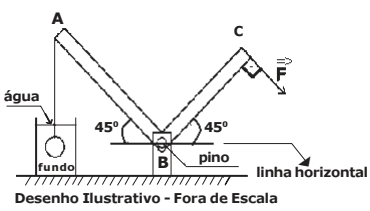
Um bloco homogêneo A de peso 6 N está sobre o bloco homogêneo B de peso 20 N ambos em repouso. O bloco B está na iminência de movimento.
O bloco A está ligado por um fio ideal tracionado ao solo no ponto X, fazendo um ângulo θ com a horizontal enquanto que o bloco B está sendo solicitado por uma força horizontal 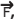 conforme o desenho abaixo.
conforme o desenho abaixo.
Os coeficientes de atrito estático entre o bloco A e o bloco B é 0,3 e do bloco B e o solo é 0,2.
A intensidade da força horizontal  aplicada ao bloco B nas condições abaixo, capaz de tornar
iminente o movimento é:
aplicada ao bloco B nas condições abaixo, capaz de tornar
iminente o movimento é:
Dados: cos θ=0,6
sen θ=0,8
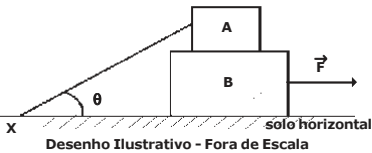
Considere o circuito elétrico ABCD abaixo, que é formado por 4 (quatro) resistores ôhmicos sendo R1 = 0,5 Ω, R2 = 1 Ω, R3 = 2 Ω, R4 = 4 Ω e 2 (dois) geradores ideais E1 e E2. Sabendo que a diferença de potencial entre os terminais do resistor R1 é zero, isto é, (VCD = 0) e que o valor da ddp (diferença de potencial) de E2 = 4 V então a ddp de E1 vale:
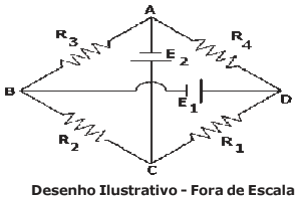
Um fio condutor no trecho KLM, sendo KL = 8,0 m e LM = 6,0 m, está dobrado em ângulo reto e está ortogonalmente inserido em um campo magnético uniforme de intensidade B = 0,40 T. Este fio está conectado a um circuito resistivo que é composto por um gerador ideal de ddp (diferença de potencial) E = 40 V e resistências ôhmicas de R1 = 8 Ω, R2 = 12 Ω e R3 = 24 Ω, conforme desenho abaixo. A intensidade da força resultante de origem magnética que atuará sobre o fio condutor no trecho KLM é:
Considere as seguintes afirmações abaixo:
I) No interior de uma esfera metálica condutora em equilíbrio eletrostático, o campo elétrico é nulo.
II) Um campo elétrico uniforme é formado entre duas placas paralelas, planas e eletrizadas com cargas opostas. Uma carga negativa é abandonada em repouso no interior dessas placas, então esta carga deslocar-se-á da região de maior potencial elétrico para a de menor potencial elétrico.
III) Um objeto eletrostaticamente carregado, próximo a um objeto em equilíbrio eletrostático, induz neste uma carga uniformemente distribuída.
IV) Uma carga puntiforme q = 1µC é deslocada de um ponto A até um ponto B de um campo elétrico. A força elétrica que age sobre q realiza um trabalho ζAB = 1 · 10-5 J, então a diferença de potencial elétrico entre os pontos A e B é 100 V.
Das afirmações, é (são) correta(s) somente:
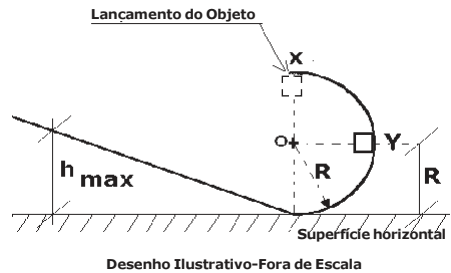
O desenho abaixo mostra um semicírculo associado a uma rampa, em que um objeto puntiforme de massa m, é lançado do ponto X e que inicialmente descreve uma trajetória circular de raio R e centro em O.
Se o módulo da força resultante quando o objeto passa em Y é √5 mg , sendo a distância de Y até a superfície horizontal igual ao valor do raio R, então a altura máxima (hmax) que ele atinge na rampa é:
DADOS: Despreze as forças dissipativas.
Considere g a aceleração da gravidade.
Considere uma máquina térmica que opera um ciclo termodinâmico que realiza trabalho.
A máquina recebe 400 J de uma fonte quente cuja temperatura é de 400 K e rejeita 200 J para uma fonte fria, que se encontra a 200 K. Neste ciclo a máquina térmica realiza um trabalho de 200 J.
• Analisando o ciclo termodinâmico exposto acima conclui-se que a máquina térmica é um ..I.. .
• Essa máquina térmica ..II.. a 1ª Lei da Termodinâmica.
• O rendimento desta máquina é ..III.. a 50%.
A opção que corresponde ao preenchimento correto das lacunas (I), (II) e (III) é:
Um campo elétrico é gerado por uma partícula de carga puntiforme Q = 5,0 · 10-6 C no vácuo.
O trabalho realizado pela força elétrica para deslocar a carga de prova q=2 · 10-8 C do ponto X para o ponto Y, que estão a 0,20 m e 1,50 m da carga Q, respectivamente, conforme o desenho abaixo é:
Dado: Constante eletrostática do vácuo k0 =9 · 109 N m2/C2

Um ponto material oscila em torno da posição de equilíbrio O, em Movimento Harmônico Simples (MHS), conforme o desenho abaixo. A energia mecânica total do sistema é de 0,1 J, a amplitude da oscilação é de 10,0 cm e o módulo da máxima velocidade é de 1 m/s. Os extremos da trajetória desse movimento têm velocidade igual a zero (v=0).
Desprezando as forças dissipativas a frequência da oscilação em Hertz (Hz) é:
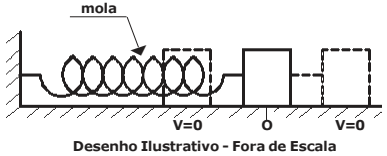
Se um corpo descreve um movimento circular uniforme, então:
• o módulo da força que age sobre o corpo é ..I.. zero;
• o vetor quantidade de movimento ..II.. com o tempo;
• o trabalho realizado pela força é ..III.. ;
• a energia cinética é ..IV.. .
A opção que corresponde ao preenchimento correto das lacunas (I), (II), (III) e (IV) é:
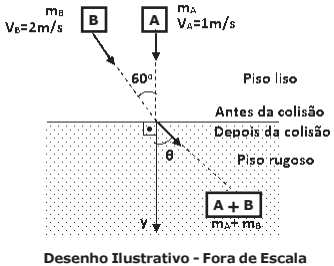
Dois blocos A e B, livres da ação de quaisquer forças externas, movem-se separadamente em um plano horizontal cujo piso é perfeitamente liso, sem atrito. (ANTES DA COLISÃO)
O bloco A tem massa mA = 1 kg e move-se com uma velocidade VA = 1 m/s, na direção do eixo y, no sentido indicado no desenho.
O bloco B tem massa mB = 1 kg e move-se com velocidade VB = 2 m/s fazendo um ângulo de 60° com o eixo y, no sentido indicado no desenho. Após a colisão movimentam-se juntos em outro piso, só que agora rugoso, com coeficiente de atrito cinético µc =0,1, conforme o desenho abaixo. (DEPOIS DA COLISÃO)
O conjunto dos blocos A e B, agora unidos, percorreu até parar a distância de:
DADOS: aceleração da gravidade g = 10 m/s2
sen 60° = √3/2 e cos 60° = 1/2