Questões Militares
Comentadas para cadete do exército
Foram encontradas 900 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Na figura abaixo ABCDEF é um hexágono regular de lado igual a 1, ABMN e CDVU são quadrados.
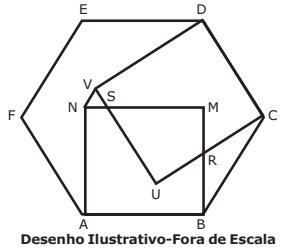
Com base nessas informações, a medida do segmento VN é igual a
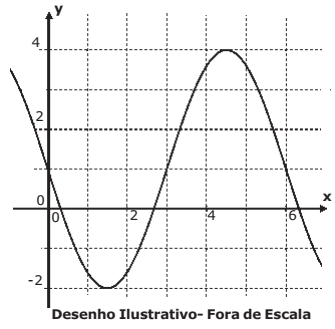
Na figura abaixo está representado um trecho do gráfico de uma função real da forma y=m·sen (nx)+k, com n > 0.
Os valores de m, n e k, são, respectivamente,
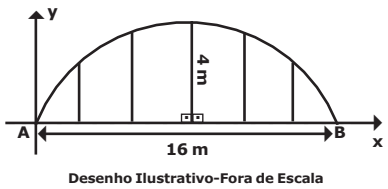
O Exército Brasileiro pretende construir um depósito de munições, e a seção transversal da cobertura desse depósito tem a forma de um arco de circunferência apoiado em colunas de sustentação que estão sobre uma viga. O comprimento dessa viga é de 16 metros e o comprimento da maior coluna, que está posicionada sobre o ponto médio da viga, é de 4 metros, conforme a figura abaixo.
Considerando um plano cartesiano de eixos ortogonais xy, com origem no ponto A, de modo que o semi-eixo x esteja na direção de AB, é correto afirmar que a função que modela o arco AB da seção transversal do telhado, com relação ao plano cartesiano de eixos xy, é dada por
“Houston, temos um problema” - Esta frase retrata um fato marcante na história das viagens espaciais, o acidente com o veículo espacial Apollo 13. Uma explosão em um dos tanques de oxigênio da nave causou a destruição parcial do veículo, obrigando os astronautas a abandonarem o módulo de comando e ocuparem o módulo lunar, demovendo-os do sonho de pisar na lua nessa missão espacial.
Não foram poucos os problemas enfrentados pelos astronautas nessa missão. Um específico referiu-se ao acúmulo de gás carbônico (dióxido de carbono - CO2) exalado pelos astronautas no interior do módulo lunar. No fato, os astronautas tiveram que improvisar um filtro com formato diferente do usado comumente no módulo. Veículos espaciais são dotados de filtros que possuem hidróxidos que reagem e neutralizam o gás carbônico exalado pelos tripulantes. Para neutralização do gás carbônico, o hidróxido mais utilizado em veículos espaciais é o hidróxido de lítio. Em sua reação com o dióxido de carbono, o hidróxido de lítio forma carbonato de lítio sólido e água líquida.
Considerando o volume de 246 L de gás carbônico produzido pelos astronautas (a 27 ºC e 1 atm), a massa de hidróxido de lítio necessária para reagir totalmente com esse gás é de
Dados: R = 0,082 atm·L·mol-1·K-1
T (Kelvin) = t (Celsius) + 273
Um aluno, durante uma aula de química orgânica, apresentou um relatório em que indicava e associava alguns compostos orgânicos com o tipo de isomeria plana correspondente que eles apresentam. Ele fez as seguintes afirmativas acerca desses compostos e da isomeria correspondente:
I - os compostos butan-1-ol e butan-2-ol apresentam entre si isomeria de posição.
II - os compostos pent-2-eno e 2 metilbut-2-eno apresentam entre si isomeria de cadeia.
III - os compostos propanal e propanona apresentam entre si isomeria de compensação (metameria).
IV - os compostos etanoato de metila e metanoato de etila apresentam entre si isomeria de função.
Das afirmativas feitas pelo aluno, as que apresentam a correta relação química dos compostos orgânicos citados e o tipo de isomeria plana correspondente são apenas
O fósforo branco, substância química cuja estrutura é representada pela fórmula P4 , é utilizado em algumas munições fumígenas (munições que produzem fumaça). Ele pode ser obtido a partir da fosforita (Ca3(PO4)2), um mineral de fosfato de cálcio, por meio da reação com sílica (dióxido de silício - SiO2) e carvão coque (C) num forno especial a 1300 ºC.
A equação não balanceada da reação é:
Ca3(PO4)2 (s) + SiO2 (s) + C (s) → CaSiO3 (s) + CO (g) + P4 (s)
Acerca deste processo, são feitas as seguintes afirmativas:
I – Após o balanceamento da equação por oxidorredução, a soma dos coeficientes estequiométricos é igual a 35.
II – O dióxido de silício é uma molécula que apresenta estrutura de geometria molecular angular.
III – O agente redutor do processo é o dióxido de silício.
IV – Neste processo ocorre a oxidação do carbono.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Neste ano de 2019, foi realizada pelos alunos da EsPCEx uma prática no laboratório de química envolvendo eletrólise com eletrodos ativos conforme a descrição experimental:
- Num béquer de capacidade 100 mL (cuba eletrolítica) coloque cerca de 50 mL de solução aquosa de sulfato de cobre II de concentração 1 mol.L-1. Tome como eletrodos uma barra fina de cobre e um prego de ferro. Ligue-os com auxílio de fios a uma fonte externa de eletricidade com uma corrente contínua de intensidade de 3 Ampères. Esta fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. O prego deve ser ligado ao polo negativo da fonte e a barra de cobre ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 16 minutos e 5 segundos e observe.
Considere o arranjo eletrolítico (a 25 ºC e 1 atm) e o sal completamente dissociado, conforme visto na figura a seguir:
Dado: 1 Faraday (F) = 96500 Coulomb (C) / mol de elétrons
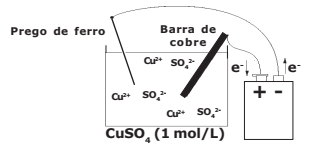
Na discussão apresentada nos relatórios dos diversos grupos de alunos, surgiram as seguintes afirmativas:
I – Na superfície do prego ocorreu a deposição de cobre metálico.
II – Durante o processo a barra de cobre se oxida.
III – A massa de cobre metálico que se depositou na superfície do prego foi de 2,45 g.
IV – A semi-reação de redução que ocorre no cátodo é Cu2+ + 2 e- → Cuº.
V – A reação global é Fe2+ + Cuº → Feº + Cu2+
Muitas sínteses químicas são baseadas em reações orgânicas que, dependendo dos reagentes e dos catalisadores, podem gerar uma infinidade de produtos.
Uma relevante questão em sínteses orgânicas está no fato de que, quando se efetuam substituições em anéis aromáticos que já contêm um grupo substituinte, verifica-se experimentalmente que a posição do segundo grupo substituinte depende da estrutura do primeiro grupo, ou seja, o primeiro ligante do anel determinará a posição preferencial do segundo grupo substituinte. Esse fenômeno denominado dirigência ocasionará a formação preferencial de alguns compostos, com relação a outros isômeros. Usa-se comumente as nomenclaturas orto (posições 1 e 2 dos grupos substituintes no anel aromático), meta (posições 1 e 3) e para (posições 1 e 4) em compostos aromáticos para a indicação das posições dos grupos substituintes no anel aromático.
A reação expressa na equação I demonstra a síntese orgânica alquilação de compostos aromáticos, denominada de alquilação de Friedel-Crafts.
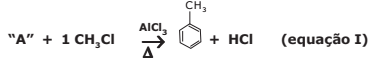
Na alquilação aromática, ocorre a ligação de grupos alquil (estrutura carbônica como os grupos -CH3) à estrutura de anéis aromáticos, pela substituição de um hidrogênio do anel. O catalisador mais comum nesse processo é o cloreto de alumínio (AlCl3).
A reação expressa na equação II é a mononitração de aromáticos e demonstra uma nitração, em que apenas um grupo nitro é adicionado à estrutura orgânica, pela substituição de um hidrogênio do anel. Usa o reagente ácido nítrico (HNO3) e o catalisador ácido sulfúrico (H2SO4).
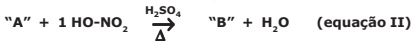
A reação expressa na equação III é a de haletos orgânicos com compostos aromáticos monossubstituídos e mostra outro processo químico denominado halogenação, no qual um átomo de halogênio é adicionado à estrutura orgânica, pela substituição de um hidrogênio do anel. Esse processo pode ser catalisado pelo FeBr3.
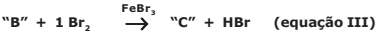
A alternativa que apresenta respectivamente o nome (aceito pela IUPAC) correto das substâncias
“A”, “B” e o composto “C”, é
Em algumas operações militares, grupos especiais utilizam artefatos explosivos, como granadas de mão, denominadas de Luz e Som (ou atordoantes). Após sua deflagração, a granada gera como efeitos um estampido muito alto e um intenso flash de luz, que atordoam o oponente. Algumas granadas deste tipo podem possuir como reagente componente principal o magnésio metálico em pó. Considerando a luz emitida por esta granada como resultado da reação química entre o magnésio metálico pulverizado e o oxigênio do ar, tem-se a equação da reação:
Mg (s) + O2 (g) → MgO (s) + luz
Acerca do magnésio e da reação descrita acima, são feitas as seguintes afirmativas:
I – Essa é uma reação de simples troca.
II – Nesta reação ocorre a oxidação do magnésio metálico.
III – Após a deflagração da granada com reação do magnésio metálico (conforme a equação da reação descrita acima), há formação de um sal de magnésio.
IV – Conforme o diagrama de Linus Pauling, a distribuição eletrônica do cátion magnésio (Mg2+) é: 1s2, 2s2, 2p6.
V – Após a deflagração da granada com reação do magnésio metálico (conforme a equação da reação descrita acima), ocorre a formação de óxido de magnésio e gás hidrogênio como produtos.
VI – As ligações químicas existentes entre os átomos de magnésio metálico são denominadas de metálicas e as ligações químicas existentes entre os átomos no óxido de magnésio são denominadas de iônicas.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Um experimento usado nas aulas práticas de laboratório da EsPCEx para compreensão da reatividade química é pautado na reação entre magnésio metálico (Mg0) e ácido clorídrico (HCl). Experimentalmente consiste em mergulhar uma fita de magnésio metálico numa solução de concentração 0,1 mol/L de ácido clorídrico. Acerca do processo acima descrito e considerando-se ocorrência de reação, são feitas as seguintes afirmativas:
I – A ocorrência da reação é evidenciada pela formação de bolhas do gás oxigênio.
II – Um dos produtos formados na reação é o óxido de magnésio.
III – O coeficiente estequiométrico do ácido clorídrico, após a escrita da equação da reação corretamente balanceada, é 2.
IV – O agente oxidante dessa reação de oxidorredução é o ácido clorídrico.
V – Considerando a solução inicial do ácido clorídrico de concentração 0,1 mol/L como 100 % ionizado (ácido forte), o pH dessa solução é 2.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima
Muitas sínteses orgânicas podem ser realizadas como uma sequência de reações químicas. Considere a sequência de reações químicas representadas a seguir, como a monocloração de alcanos (1ª etapa) e a reação de haletos orgânicos com compostos aromáticos (2ª etapa).

Para obtenção de um haleto orgânico, na primeira etapa é feita uma reação de halogenação (“substituição de hidrogênios de compostos orgânicos por átomos de haletos como o cloro, denominada de reação de cloração”).
Em seguida, na segunda etapa, é feito um processo conhecido por reação de alquilação Friedel-Crafts (“reação de haletos orgânicos com compostos aromáticos ou, simplesmente, a ligação de grupos alquil à estrutura de compostos orgânicos como anéis aromáticos”).
Acerca das substâncias correspondentes, representadas genericamente pelas letras “A” e “B”, são feitas as seguintes afirmativas:
I – O nome (aceito pela IUPAC) da substância “A” é cloroetano.
II – O nome (aceito pela IUPAC) da substância “B” é o etilbenzeno.
III – Todos os carbonos da substância “B” apresentam hibridização sp2.
IV – A fórmula molecular da substância “B” é C8H10.
V – O processo de alquilação, representado pela equação da reação na segunda etapa, pode ser classificado como reação de substituição.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Um analista químico realizou um experimento em que utilizou 200 mL de uma solução de concentração 2 mol/L de ácido clorídrico (HCl) para reagir com uma certa massa de bicarbonato de sódio (também denominado de hidrogenocarbonato de sódio). Notou que nem todo o ácido reagiu com essa massa de bicarbonato de sódio, restando um excesso de ácido. Ao final do experimento, ele obteve um volume de 6,15 L de gás carbônico, medidos a 27 ºC e 1 atm. Esse gás carbônico é oriundo da decomposição do ácido carbônico produzido na reação.
Dados: R = 0,082 atm·L·mol-1·K-1
T (Kelvin) = t (Celsius) + 273
Esse analista fez as seguintes afirmativas:
I – A equação química balanceada que descreve corretamente a reação citada é:
Na2CO3 + 2 HCl → H2CO3 + 2 NaCl
II – Para a formação de 6,15 L de CO2, foram consumidos 21 g de bicarbonato de sódio.
III – É uma reação de oxidorredução e o ácido clorídrico é o agente oxidante.
IV – Se todo esse ácido clorídrico fosse consumido numa reação completa com bicarbonato de sódio suficiente, o volume de gás carbônico produzido seria de 9,84 L.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.