Questões Militares
Comentadas para cadete do exército
Foram encontradas 900 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Na figura a seguir, ABCD é um quadrado, E é o ponto médio de BC e F é o ponto médio de DE
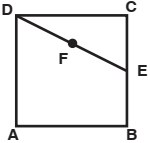
A razão entre as áreas do quadrado ABCD e do triângulo AEF, nessa ordem, é
Nestes últimos anos, os alunos da EsPCEx têm realizado uma prática no laboratório de química envolvendo eletrólise com eletrodos inertes de grafite. Eles seguem um procedimento experimental conforme a descrição:
- Num béquer de capacidade 100 mL (cuba eletrolítica) coloque cerca de 50 mL de solução aquosa de sulfato de zinco (ZnSO4) de concentração 1 mol·L-1. Tome como eletrodos duas barras finas de grafite. Ligue-as com auxílio de fios a uma fonte externa de eletricidade (bateria) com corrente de 2 Ampères. Esta fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. Uma das barras deve ser ligada ao polo negativo da fonte e a outra barra ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 32 minutos e 10 segundos e observe.
Considere o arranjo eletrolítico (a 25 ºC e 1 atm), conforme visto na figura a seguir:
Dados: 1 Faraday (F) = 96500 Coulomb (C) / mol de elétrons
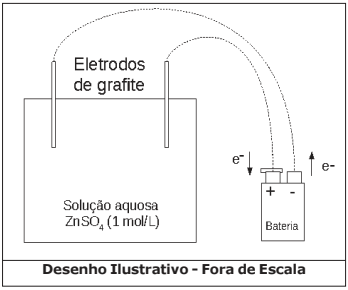
Acerca do experimento e os conceitos químicos envolvidos são feitas as seguintes afirmativas:
I – Na superfície da barra de grafite ligada como cátodo da eletrólise ocorre a eletrodeposição do zinco metálico.
II – A semirreação de oxidação que ocorre no ânodo da eletrólise é Zn (s) → Zn2+ (aq) + 2 e- .
III – Durante o processo a barra de grafite ligada ao polo positivo da bateria se oxida.
IV – No ânodo da eletrólise ocorre uma reação de oxidação da hidroxila com formação do gás oxigênio e água.
V – A massa de zinco metálico obtida no processo de eletrólise será de 0,83 g.
Das afirmativas feitas, estão corretas apenas
Ao emitir uma partícula Alfa (α), o isótopo radioativo de um elemento transforma-se em outro elemento químico com número atômico e número de massa menores. A emissão de uma partícula beta (β) por um isótopo radioativo de um elemento transforma-o em outro elemento de mesmo número de massa e número atômico uma unidade maior.
Baseado nessas informações são feitas as seguintes afirmativas:
I – Na desintegração  ocorre com a emissão de uma partícula β.
ocorre com a emissão de uma partícula β.
II – Na desintegração  ocorre com a emissão de uma partícula β.
ocorre com a emissão de uma partícula β.
III – A partícula alfa (α) é composta por 2 prótons e 4 nêutrons.
IV – Uma partícula beta (β) tem carga negativa e massa comparável a do próton.
V – O urânio-238 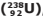 , pode naturalmente sofrer um decaimento radioativo emitindo
sequencialmente 3 partículas alfa e 2 beta, convertendo-se em rádio
, pode naturalmente sofrer um decaimento radioativo emitindo
sequencialmente 3 partículas alfa e 2 beta, convertendo-se em rádio  .
.
Das afirmativas feitas, estão corretas apenas
Diagramas de fases são gráficos construídos para indicar uma condição de temperatura e pressão de uma substância e suas mudanças de estado. Cada uma das curvas do diagrama indica as condições de temperatura e pressão nas quais as duas fases de estado estão em equilíbrio.
Modificado de USBERCO, João e SALVADOR, Edgard, Físico-química, São Paulo, Ed Saraiva, 2009, Pág. 98
Considere o diagrama de fases da água, representado na figura abaixo:
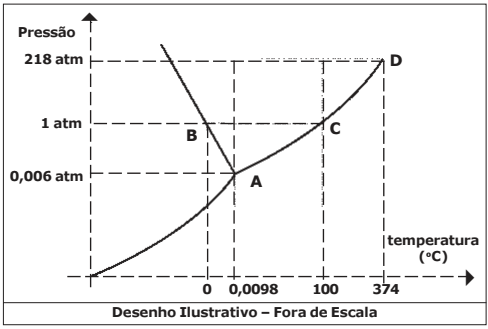
Baseado no diagrama e nos processos químicos envolvidos são feitas as seguintes afirmativas:
I – A temperatura de fusão da água aumenta com o aumento da pressão.
II – Na temperatura de 100 ºC e 218 atm a água é líquida.
III – A água sólida (gelo) sublima a uma pressão de vapor superior a 1 atm.
IV – Na temperatura de 0 ºC e pressão de 0,006 atm, a água encontra-se na fase sólida.
Das afirmativas feitas, estão corretas apenas
O ácido etanoico, também denominado usualmente de ácido acético, é um ácido orgânico e uma das substâncias componentes do vinagre. Considerando-se a substância ácido etanoico, pode-se afirmar que:
I – É um composto cuja fórmula molecular é C2H6O.
II – Possui apenas ligações covalentes polares entre seus átomos.
III – Possui um carbono com hibridização sp2.
IV – Possui dois carbonos assimétricos (quiral).
V – O anidrido etanoico (acético) é isômero de cadeia do ácido etanoico (acético).
VI – Pode ser obtido pela oxidação enérgica do but-2-eno em presença do permanganato de potássio e ácido concentrado.
VII – Em condições adequadas, sua reação com sódio metálico produz etanoato de sódio e libera H2.
Das afirmativas feitas, estão corretas apenas
Modelo Característica(s) do Modelo I Átomo contém espaços vazios. No centro do átomo existe um núcleo muito pequeno e denso. O núcleo do átomo tem carga positiva. Para equilíbrio de cargas, existem elétrons ao redor do núcleo. II Átomos maciços e indivisíveis. III Elétrons movimentam-se em órbitas circulares em torno do núcleo atômico central. A energia do elétron é a soma de sua energia cinética (movimento) e potencial (posição). Essa energia não pode ter um valor qualquer, mas apenas valores que sejam múltiplos de um quantum (ou de um fóton). Os elétrons percorrem apenas órbitas permitidas.
A alternativa que apresenta a correta correlação entre o cientista proponente e o modelo atômico por ele proposto é
Gases apresentam um fenômeno chamado de difusão de gases.
“Difusão gasosa é o movimento espontâneo das partículas de um gás de se espalharem uniformemente em meio das partículas de um outro gás ou de atravessarem uma parede porosa.
Quando gases diferentes (A e B) estão a uma mesma temperatura, para uma quantidade de matéria igual a 1 mol de gás A e 1 mol de gás B, tem-se que a massa do gás A (ma) será igual à massa molar do gás A (Ma), e a massa do gás B (mb) será igual à massa molar do gás B (Mb).”
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007,
Pág. 110
Considere que, em determinadas condições de temperatura e pressão, a velocidade de difusão de 1 mol do gás hidrogênio (H2) seja de 28 km/min. Nestas mesmas condições a velocidade (em km/h) de 1 mol do gás metano (CH4) é de
Dado: √2 = 1,4
“No fenômeno físico, a composição da matéria é preservada, ou seja, permanece a mesma antes e depois da ocorrência do fenômeno”.
“Reação química é toda transformação que modifica a natureza da matéria (fenômenos químicos)”.
“No fenômeno químico, a composição da matéria é alterada: sua composição antes de ocorrer o fenômeno é diferente da que resulta no final”.
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 24 e 61.
Considere os conceitos supracitados e as transformações representadas pelas equações químicas a seguir:
I – CaCO3 (s) → CaO (s) + CO2 (g)
II – H2O (l) →H2O (g)
III – H2 (g) + O2 (g) → H2O (g)
IV – C(grafite) + O2 (g) → CO2 (g)
Correspondem a reações químicas apenas as transformações
“Solução saturada: solução que contém a quantidade máxima de soluto em determinada quantidade de solvente, a determinada temperatura; a relação entre quantidades máximas de soluto e quantidade de solvente é denominada de coeficiente de solubilidade”.
“Solução insaturada: quando a solução contém uma quantidade de soluto inferior ao seu coeficiente de solubilidade, na temperatura em que se encontra a solução”.
“Solução supersaturada: quando a solução contém uma quantidade de soluto dissolvido superior ao seu coeficiente de solubilidade, na temperatura em que se ela se encontra. É instável” .
USBERCO, João e SALVADOR, Edgard, Físico-química, São Paulo, Ed Saraiva, 2009, Pág. 18
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 18 e 19.
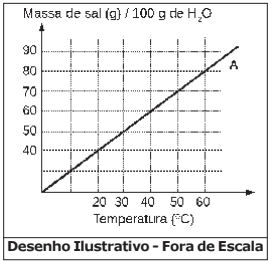
Considere o gráfico da curva de solubilidade em função da temperatura para um sal hipotético A. No gráfico, a linha contínua representa a solubilidade máxima do soluto (sal A) em 100 g de água na temperatura correspondente.
Acerca desse gráfico e processo de solubilidade são feitas as seguintes afirmativas:
I – Na temperatura de 20 ºC, misturando-se 50 g do sal A em 100 g de água, ter-se-á um sistema heterogêneo.
II – Na temperatura de 40 ºC, a adição de 50 g do sal A em 100 g de água produzirá uma solução insaturada.
III – 200 g de água dissolvem totalmente 90 g do sal A a 30 ºC.
IV – Uma solução contendo 60 g do sal A em 100 g de água será saturada em 60 ºC.
Das afirmativas feitas estão corretas apenas
O carbeto de cálcio, de fórmula CaC2 , é muito comum em equipamentos usados por exploradores de cavernas para fins de iluminação. Ele reage com água e gera como um dos produtos o gás acetileno (etino), de fórmula C2H2, conforme mostra a equação, não balanceada, a seguir
CaC2 (s) + H2O (l) → C2H2 (g) + Ca(OH)2 (s) (equação 1)
Sequencialmente, esse gás inflamável pode sofrer uma reação de combustão completa, liberando intensa energia, conforme a equação, não balanceada, a seguir
C2H2 (g) + O2 (g) → CO2 (g) + H2O (g) + calor (equação 2)
Uma massa de 512 g de carbeto de cálcio com pureza de 50% (e 50% de materiais inertes) é tratada com água, obtendo-se uma certa quantidade de gás acetileno. Esse gás produzido sofre uma reação de combustão completa.
Considerando a reação de combustão completa do acetileno nas condições ambientes (25ºC e 1 atm), o volume de gases obtidos e o valor da energia liberada como calor nessa reação, a partir da massa original de carbeto de cálcio, são, respectivamente,
Dados:
– volume molar na condição ambiente = 24,5 L · mol-1 (25ºC e 1 atm); calor de combustão do etino = -1298 kJ · mol-1 ; e
– constante universal dos gases R=0,082 L · atm · mol-1 · K-1 .