Questões Militares
Foram encontradas 735 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Leia o texto a seguir e resolva a questão:
“Quando se efetuam duas substituições em um anel aromático, verifica-se experimentalmente que a posição da segunda substituição no anel depende da estrutura do primeiro grupo substituinte, ou seja, o primeiro ligante do anel determinará a posição preferencial para a outra substituição. Esse fenômeno recebe o nome de dirigência e existem somente dois tipos de dirigentes: ortoparadirigentes e metadirigentes.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 3: Química Orgânica. p. 318.
Considere a mononitração de um composto hipotético de fórmula C6H5X, em presença de ácido sulfúrico como catalisador. Esta mononitração pode gerar como produtos os compostos A, B e C, cuja reação é representada abaixo:
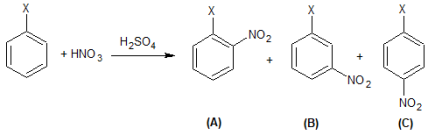
Acerca dessa reação e de seus compostos, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de condensação.
II – Caso X seja um haleto, os compostos A e C serão os produtos preferencialmente formados na reação.
III – Caso X seja o grupo metila (–CH3), o composto B será o produto preferencialmente formado na reação.
IV – Caso X seja o grupo nitro (–NO2), o composto B será o produto preferencialmente formado na reação.
V – Os compostos A, B e C são isômeros de função.
Das afirmativas feitas, estão corretas apenas
Considere a equação da reação hipotética: X + Y + Z → W + T + Q
São conhecidos os seguintes resultados do estudo cinético desta reação, obtidos nas mesmas condições experimentais:
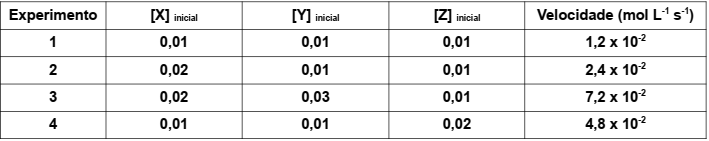
Considere [ ] = concentração mol L-1
.
A partir das observações experimentais, conclui-se que a equação da velocidade para a reação é
“Em 1836, o químico inglês John Frederic Daniell construiu uma pilha usando metais e soluções aquosas de sais. A pilha funcionava a partir de dois eletrodos interligados. O eletrodo é, geralmente, um sistema constituído por um metal imerso em uma solução aquosa de um sal formado pelos cátions desse metal.”
Adaptado de: FONSECA, Martha Reis Marques. Química. São Paulo: Editora FTD, 2007. v. 2: Físico-Química. p. 276.
Considere a representação da notação química da pilha de Daniell (usando eletrodos de cobre e zinco), de acordo com a União Internacional de Química Pura e Aplicada (IUPAC):
Zn (s) | Zn2+ (aq) (1 mol L-1) || Cu2+ (aq) (1 mol L-1) | Cu (s).
Dados os potenciais padrão de redução E0 Zn = - 0,76 V e E0 Cu = + 0,34 V, e considerando o funcionamento da referida pilha em condições padrão, afirma-se que
I – no eletrodo de cobre dessa pilha ocorre a corrosão da placa metálica de cobre.
II – a diferença de potencial (d.d.p.) teórica dessa pilha é de + 1,10 V.
III – nessa pilha os elétrons fluem no circuito externo, do eletrodo de zinco para o eletrodo de cobre.
IV – o símbolo de duas barras paralelas ( || ) representa a ponte salina (ou uma membrana porosa), cuja finalidade é manter as duas semicelas eletricamente neutras, por meio da migração de íons (corrente iônica).
V – a equação da reação global dessa pilha é Zn2+ (aq) + Cu (s) → Zn (s) + Cu2+ (aq).
Das afirmativas feitas, estão corretas apenas
Leia os textos a seguir e resolva a questão:
“Nas equações químicas, tanto as substâncias transformadas (reagentes) como as produzidas são representadas por fórmulas. As fórmulas das substâncias indicam elementos que as constituem e, também, a quantidade de átomos de cada elemento. O número que indica essa quantidade de átomos é chamado índice, que é anotado à direita do símbolo de cada elemento. (...)
A quantidade de cada substância que participa da reação é indicada por números escritos antes de suas fórmulas, denominados coeficientes estequiométricos, que devem ser os menores números inteiros possíveis.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 1: Química Geral. p. 385.
“Em uma reação de oxidorredução, o mais comum é que uma espécie se oxide e outra se reduza. Porém, podem ocorrer casos com duas ou mais oxidações e apenas uma redução ou viceversa. De qualquer maneira, para o balanceamento desse tipo de reação, o princípio é sempre o mesmo: n° de elétrons perdidos = n° de elétrons recebidos.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 2: Físico-Química. p. 250.
Considere a seguinte equação de reação química de oxidorredução não balanceada:
As2S3 + NH4OH + H2O2 → (NH4)3AsO4 + (NH4)2SO4 + H2O
Acerca desta reação química de oxidorredução e de suas espécies, são feitas as seguintes afirmativas:
I – O peróxido de hidrogênio é o agente redutor.
II – Após o devido balanceamento, o coeficiente estequiométrico da água é 20.
III – O arsênio da substância As2S3 é reduzido, enquanto o enxofre é oxidado.
IV – O (NH4)2SO4 é um sal cujo nome é sulfito de amônio.
V – Após o devido balanceamento, a soma de todos os coeficientes estequiométricos da equação é igual a 52.
Das afirmativas feitas, estão corretas apenas
No estado sólido, o dióxido de carbono é conhecido como gelo seco. Em condições ambientes (25 ºC e 1 atm), ele passa do estado sólido para o estado de vapor. Acerca do dióxido de carbono, são feitas as seguintes afirmativas:
I – O dióxido de carbono é classificado como uma substância simples.
II – O dióxido de carbono é uma substância que sublima em condições ambientes.
III – A molécula do dióxido de carbono apresenta geometria angular.
IV – O dióxido de carbono é um óxido ácido que, em condições adequadas, pode reagir com água e produzir o ácido carbônico.
V – Quando se borbulha dióxido de carbono em uma solução aquosa de hidróxido de cálcio, sob condições adequadas, produz-se carbonato de cálcio e água.
VI – A hibridização do átomo de carbono na molécula do dióxido de carbono é sp2 .
Das afirmativas feitas, estão corretas apenas