Questões Militares
Para técnico - química
Foram encontradas 300 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
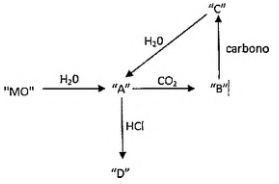
Na figura abaixo, "MO” representa um óxido de um elemento do Grupo 2 da Tabela Periódica. Assinale a opção que identifica corretamente os elementos “A”, “B”, “C" e "D”, respectivamente.
Observe a reação a seguir:
NH3(aq) + H2O(I) -> NH4+(aq ) + OH- (aq)
Essa reação química ocorre quando a amônia é dissolvida em água. Sobre a natureza dos ácidos e bases, assinale a opção correta.
O calorímetro é utilizado no laboratório para inúmeros propósitos, incluindo a determinação da energia produzida na queima de combustíveis e o conteúdo calórico dos alimentos. Numa bomba calorimétrica, assume-se que a quantidade de calor absorvido (ou liberado) pela combinação de água, o interior do calorímetro, a bomba e a mistura reagente seja igual à produzida (ou absorvida) pela reação que ocorre na bomba. Considerando que uma amostra de 0,728 g de etanol (álcool de cereais, C2H5OH) é queimada numa bomba calorimétrica com uma quantidade de gás oxigênio (sob pressão) suficiente para assegurar a combustão completa, qual é o calor molar de combustão do etanol, sabendo que, nesse experimento, a quantidade de água no calorímetro é de 1,20 kg e que a temperatura aumenta de 24,86°C para 29,18°C?
Dados: capacidade calorífica do interior do calorímetro (sem água) é de 1,06 kJ °C-1 e a capacidade calorífica molar da água é 75,3 J °C-1 mol-1.
TERMOS
I - Eluição
II - Fase Móvel
III- Fase Estacionária
IV - Tempo de Retenção
DEFINIÇÕES
( ) É o tempo compreendido entre duas análises cromatográficas sucessivas.
( ) É a Lavagem de uma espécie através da coluna por adição contínua de novos volumes de solvente,
( ) É imiscível, fixa e colocada na coluna ou em uma superfície sólida.
( ) É o tempo, após a injeção da amostra, que o pico do analito leva para atingir o detector.
( ) Transporta a amostra e pode ser gás, liquido ou um fluido supercrítico.
4C(S) + S8(S) → 4 CS2(1) ΔH = + 358,8 kJ
Se o calor absorvido durante a reação foi de 3588 kj, quantos mols de CS2 foram produzidos?
Analise as afirmativas abaixo sobre análise titrimétrica.
I - Em titrimetria, alguns produtos químicos são frequentemente usados em determinadas concentrações como soluções de referência. Essas substâncias são conhecidas como padrões primários ou padrões secundários.
II - Um padrão secundário é um composto que pode ser usado nas padronizações e cujo teor de substância ativa foi determinado por comparação contra um outro padrão secundário.
III- Em uma titulação espectrofotométrica, o ponto final é avaliado a partir de dados de absorbância da solução. Como as titulações espectrofotométricas são feitas em frascos nos quais o caminho ótico é constante, a absorbância é inversamente proporcional a concentração.
IV - Em uma titulação potenciométrica, um dos eletrodos deve permanecer em potencial constante não necessariamente conhecido. O outro eletrodo, que indica as mudanças de concentração iônica, deve ter resposta rápida.
Assinale a opção correta.
O fósforo branco é uma das formas alotrópicas do fósforo e foi usado durante a Primeira e a Segunda Guerras Mundiais como componente de munição incendiária capaz de causar terríveis queimaduras e problemas respiratórios.
Assinale a característica abaixo referente ao fósforo branco
2NO (g) + O2(g),→ 2NO2(g) ΔH = ?
Qual o valor da entalpia padrão da reação acima?
Dados:
N2(g) + O2(g) → 2NO(g) ΔH = +180,5 kJ
N2(g) + 2O2(g) → 2NO2(g) ΔH = + 66,4 kJ